
| A. | 形成酸雨的主要物质是硫的氧化物和氮的氧化物 | |
| B. | 海洋元素--溴的提取常用“空气吹出法”,该制备方法中溴元素依次经过被氧化、被还原、被氧化的三过程 | |
| C. | 绿色化学的核心就是如何对被污染的环境进行无毒无害的治理 | |
| D. | 水华、赤潮等水体污染主要是由含氮、磷的生活污水任意排放造成的 |
分析 A.N、S的氧化物可形成酸雨;
B.海水中溴以离子存在,需要浓缩后氧化,再发生SO2+Br2+2H2O═4H++2Br-+SO42-,最后再氧化;
C.绿色化学的核心是从源头上减少污染物的使用;
D.含氮、磷的生活污水可导致水中藻类植物大量生长.
解答 解:A.二氧化氮、二氧化硫可形成酸雨,则形成酸雨的主要物质是硫的氧化物和氮的氧化物,故A正确;
B.海水中溴以离子存在,需要浓缩后氧化,再发生SO2+Br2+2H2O═4H++2Br-+SO42-,最后再氧化,则该制备方法中溴元素依次经过被氧化、被还原、被氧化的三过程,故B正确;
C.绿色化学的核心是从源头上减少污染物的使用,而不能污染后再治理,故C错误;
D.含氮、磷的生活污水可导致水中藻类植物大量生长,则水华、赤潮等水体污染主要是由含氮、磷的生活污水任意排放造成的,故D正确;
故选C.
点评 本题考查海水资源应用及三废处理、环境保护,为高频考点,把握海水中溴离子的存在及溴的提取、常见的环境污染物及环境问题为解答的关键,侧重分析与应用能力的考查,注意化学与环境的联系,题目难度不大.


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:实验题
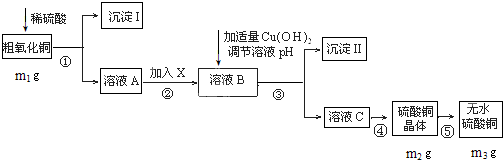
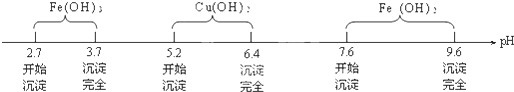
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
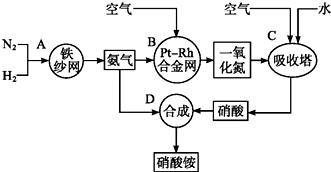
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 微粒符号 | 质子数 | 中子数 | 电子数 | 质量数 |
| (1)K | ||||
| (2) | 18 | 20 | ||
| (3) | 16 | 18 | 32 |
 ,画出表中(3)的微粒结构示意图为
,画出表中(3)的微粒结构示意图为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
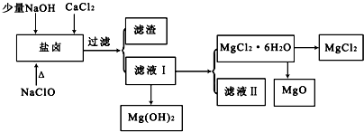
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
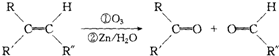
 +2H2O,反应类型是酯化反应.D与碳酸氢钠反应的化学方程式是HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2↑+2H2O.
+2H2O,反应类型是酯化反应.D与碳酸氢钠反应的化学方程式是HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2↑+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=-114.6kJ/mol | |
| B. | 由4P(s,红磷)=P4(s,白磷):△H>0可知,白磷的热稳定性比红磷大 | |
| C. | 己知:S(g)+O2(g)=SO2(g);△H1及S(s)+O2(g)=SO2(g):△H2,则△H1<△H2 | |
| D. | 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
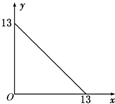 某温度(t℃)下的溶液中,[H+]=10-xmol•L-1,[OH-]=10-y mol•L-1,x与y的关系如图所示,请回答下列问题:
某温度(t℃)下的溶液中,[H+]=10-xmol•L-1,[OH-]=10-y mol•L-1,x与y的关系如图所示,请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com