
【题目】下列措施是为了降低化学反应速率的是( )
A.合成氨的反应中,选择“触媒”作催化剂
B.保存浓硝酸时,通常用棕色瓶并放在阴凉处
C.在试管中进行铝和氢氧化钠溶液反应时,稍微加热
D.用纯锌与稀硫酸反应制取氢气时,在溶液中加入少量硫酸铜溶液
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F为前四周期原子序数依次增大的六种元素,A、C、D原子均有两个未成对电子,A、B、C同周期,A与D、B与F分别同主族,E是生活中用量最大的金属。请回答下列问题:
(1)E比较稳定的离子核外电子排布式_____________________________.
(2)A、B、C的第一电离能由小到大的顺序为_________________![]() 用元素符号表示
用元素符号表示![]() 、B、C的简单氢化物中最易汽化的物质的化学式___________.
、B、C的简单氢化物中最易汽化的物质的化学式___________.
(3)C与D形成的物质的晶体类型是____________,IT产业中该晶体用于生产____________.
(4)由A、B、C三种元素中的一种或两种元素形成的分子中,有的互为等电子体,写出其中一组等电子体的化学式:______![]() 并写出对应的结构式_______________.
并写出对应的结构式_______________.
(5)B的单质晶胞与![]() 的相似,则一个晶胞中含B的原子个数为____
的相似,则一个晶胞中含B的原子个数为____![]() 与氢形成的分子空间构型是_______.
与氢形成的分子空间构型是_______.
(6)“砒霜”是一种含C,F的化合物,其分子结构如图1所示,该化合物的分子式为F4C6,F原子采取______杂化;C,D,E组成的化合物的晶胞如图2,其晶胞参数为a pm,则其密度为___________________g/cm3(列出式子即可,阿伏伽德罗常数为NAmol-1)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究氨气及氨水的还原性,某兴趣小组同学设计了以下探究活动。
I.探究氨气的还原性
该兴趣小组同学利用以下装置(夹持,加热仪器略)探究氯气与氨气的反应,其中A、F分别为氯气和氨气的发生装置,B为纯净干燥的氯气与氨气反应的装置。
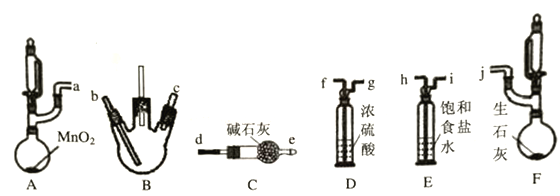
请回答下列问题:
(1)上述装置接口的连接顺序为a接h、i接f、g接___、____接___、____接j,其中装置D的作用是____________。
(2)若氨气足量,装置B中出现的现象为____________。
II.探究氨水的还原性
该兴趣小组同学探究不同条件下高锰酸钾溶液与氨水的反应,实验如下:
实验 | 操作 | 现象 |
① | 取2mL.0.01mol/LKMnO4溶液于试管中,加入新开封1mL浓氨水,加入半滴管蒸馏水,振荡,用橡皮塞塞住。 | 产生棕褐色物质(MnO2),约10min后溶液紫红色变浅 |
② | 取2mL0.01mol/LKMnO4溶液于试管中,加入新开封1mL浓氨水,加入半滴管1:5的硫酸,振荡,用橡皮塞塞住。 | 产生棕褐色物质(MnO2),溶液紫红色立刻变浅,约2min后溶液紫红色完全退去 |
③ | 取2mL0.1mol/LKMnO4溶液于试管中,加入新开封ImL浓氨水,加入半滴管蒸馏水,振荡,用橡皮塞塞住。 | 产生棕褐色物质(MnO2),约10min后溶液紫红色变浅 |
④ | 取2mL0.1mol/LKMnO4溶液于试管中,加入新开封1mL浓氨水,加人半滴管1:5的硫酸,振荡,用橡皮塞塞住。 | 产生棕褐色物质(MnO2),溶液紫红色立刻变浅,约5min后溶液紫红色完全退去 |
(3)实验①中氧化产物为N2,写出该反应的离子方程式:_________。
(4)实验①②说明________________。
(5)实验②比实验④反应速率_____(填“快“或“慢”),原因是_________。
(6)1:5的硫酸溶液(密度为ρ2g·cm-3),可用质量分数为98%的浓硫酸(密度为ρ1g·cm-3)和
蒸馏水按体积比1:5配成,则该1:5的硫酸溶液的物质的量浓度为_____mol/L。(用含ρ1、ρ2的式子表示)
(7)由实验I、II可得出的结论是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液。下列图像中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量) ( )
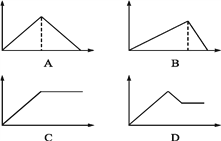
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的性质比较不正确的( )
A.热稳定性:HCl>HBr
B.沸点:H2O>H2S
C.碱性:Ca(OH)2>Mg(OH)2
D.酸性:H3PO4>H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷存在于人体所有细胞中,是维持骨骼和牙齿的必要物质,几乎参与所有生理上的化学反应。磷的化合物在药物生产和农药制造等方面用途非常广泛。请回答下列有关问题:
(1)画出基态P原子的核外电子排布图__________。
(2)NH3比PH3易液化的原因是_________。
(3)P4S3可用于制造火柴,其结构如图1所示。
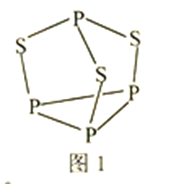
①P4S3中硫原子的杂化轨道类型为________。
②电负性:磷_____硫(填“>”或“<”);第一电离能磷大于硫的原因是________。
(4)NH4BF4是合成氮化硼纳米管的原料之一,1molNH4BF4中含有____mol配位键。
(5)NF3的键角小于NH3的键角,其原因是____________。
(6)磷化硼是一种超硬耐磨涂层材料,其晶胞结构如图2所示。原子坐标参数表示晶胞内部各原子的相对位置,图中a点和c点的原子坐标参数依次为(0,0,0)、(1,![]() ,
,![]() ),则b点的原子坐标参数为________;已知该晶胞中距离最近的两个磷原子的核间距离为Lpm,则该晶体密度为_____g.cm-3(阿伏加德罗常数用NA表示,列出计算式即可)。
),则b点的原子坐标参数为________;已知该晶胞中距离最近的两个磷原子的核间距离为Lpm,则该晶体密度为_____g.cm-3(阿伏加德罗常数用NA表示,列出计算式即可)。
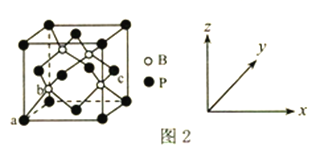
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子检验的方法正确的是( )
A. 向某溶液中加入硝酸银溶液,生成白色沉淀,说明原溶液中有Cl-
B. 向某溶液中加入氯化钡溶液,生成白色沉淀,说明原溶液中有SO![]()
C. 向某溶液中加入氢氧化钠溶液,生成蓝色沉淀,说明原溶液中有Cu2+
D. 向某溶液中加入氯化钡溶液,生成白色沉淀,再加盐酸沉淀不溶解,说明原溶液中有SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有Fe、FeO、Fe2O3和Fe3O4组成的混合物,取一定质量,加入100 mL 4 mol/L的盐酸,混合物恰好完全溶解,放出a mL(标准状况下)的气体,所得溶液中加入KSCN溶液无血红色出现。若取等质量的该混合物,用足量的CO还原可得铁单质的质量为
A.2.8g B.5.6g C. 8.4g D.11.2 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用浓度为0.1000mol·L-1的NaOH溶液滴定20.00mL浓度为0.1000mo l·L-1的某酸HX,滴定曲线如图所示。下列说法正确的是( )

A. HX的电离常数Ka的数量级为10-10
B. P点溶液中微粒浓度大小为:c(Na+)>c(HX)>c(X-)>c(OH-)>c(H+)
C. 滴定过程中可选用的指示剂有甲基橙和酚酞
D. A点到B点过程中,水电离出的c(H+)×c(OH-)先增大,后不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com