
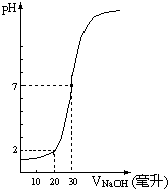
 下图为10mL一定物质的量浓度的盐酸X,用一定物质的量浓度的NaOH溶液Y滴定的图示,据图推出NaOH溶液和盐酸的物质的量的浓度是( )
下图为10mL一定物质的量浓度的盐酸X,用一定物质的量浓度的NaOH溶液Y滴定的图示,据图推出NaOH溶液和盐酸的物质的量的浓度是( )| A | B | C | D | |
| c(HCl)(mol/L) | 0.12 | 0.04 | 0.18 | 0.09 |
| c(NaOH)(mol/L) | 0.04 | 0.12 | 0.06 | 0.03 |
| c(HCl).V(HCl)-c(NaOH).V(NaOH) |
| V(HCl)+V(NaOH) |
| c(HCl).V(HCl)-c(NaOH).V(NaOH) |
| V(HCl)+V(NaOH) |
| 3C(NaOH)×0.01L-C(NaOH)×0.02L |
| 0.01L+0.02L |
| c(HCl).V(HCl)-c(NaOH).V(NaOH) |
| V(HCl)+V(NaOH) |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (2013?闸北区二模)含有硫的化合物在工业生产中应用广泛,回答下列问题:
(2013?闸北区二模)含有硫的化合物在工业生产中应用广泛,回答下列问题:| 装置 | A (试管+粉末) |
B | C |
| 反应前 | 42.0g | 75.0g | 140.0g |
| 反应后 | 37.0g | 79.0g | 140.5g |
| 高温 |
| 高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| Cu2O |
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(16分)应用化学反应需要研究化学反应的条件、限度和速率。
(1)已知反应:Br2+2Fe2+=2Br-+2Fe3+ ,向10mL 0.1 mol·L-1的FeBr2溶液中通入0.001 mol Cl2,反应后,溶液中除含有Cl-外,还一定有 (填序号)。
①含Fe2+,不含Fe3+② 含Fe3+,不含Br-③ 含Fe3+,还含有Br-
(2)773 K、固定体积的容器中,反应CO(g)+2H2(g)CH3OH(g)过程中能量变化如下图。曲线Ⅱ表示使用催化剂时的能量变化。若投入amol CO、2a mol H2,平衡时能生成0.1a mol CH3OH,反应就具工业应用价值。
①若按上述投料比使该反应具有工业应用价值,CO的平衡转化率最小为 ;
②在容器容积不变的前提下,欲提高H2的转化率,可采取的措施(答两项即可) 、 ;
③下列与催化剂有关的说法中,正确的是 (填字母序号)。
a. 使用催化剂,使反应CO(g)+2H2(g)CH3OH(g) ΔH>-91kJ·mol-1
b. 使用催化剂, 能够提高反应物转化率
c. 使用催化剂,不能改变反应的平衡常数K
(3)高铁酸盐在能源环保领域有广泛用途。我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的方案,装置如右图所示。
① Ni作 (填“阴”或“阳”)极;
②Ni电极的电极反应式为: 。
(4)氧化还原反应中实际上包含氧化和还原两个过程。下面是HNO3发生的一个还原过程的反应式:NO-3+4H++3e-→NO+2H2O
①KMnO4、HCl、Fe(NO3)2、CuO、KI五种物质中的 (填化学式)能使上述还原过程发生。
②欲用下图装置通过测定气体生成量测算硝酸被还原的速率,当反应物的浓度、用量及其他影响速率的条件确定之后,可以通过测定 推(计)算反应速率。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年上海市闸北区高三下学期二模化学试卷(解析版) 题型:计算题
含有硫的化合物在工业生产中应用广泛,回答下列问题:
(1)黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2。
①测得某黄铜矿(CuFeS2)中含硫20%(质量分数),求该矿石含铜的质量分数。
②现有一种天然黄铜矿(含少量脉石),为了测定该黄铜矿的纯度,某同学设计了如下实验:称取
研细的黄铜矿样品1.150g,在空气中进行煅烧,生成Cu、Fe3O4和SO2气体,用100 mL滴有淀粉的
蒸馏水全部吸收SO2,然后取10mL吸收液,用0.05mol/L标准碘溶液进行滴定,用去标准碘溶液的体
积为20.00mL。求该黄铜矿的纯度。
(2)将FeS和Fe2O3的混和物56.6 g,用足量稀H2SO4溶解后可得3.2 g硫,原混和物中FeS的质量。
(3)一定温度下,硫酸铜受热分解生成CuO、SO2、SO3和O2。已知:SO2、SO3都能被碱石灰和氢氧
化钠溶液吸收。利用下图装置加热无水硫酸铜粉末直至完全分解。若无水硫酸铜粉末质量为10.0 g,
完全分解后,各装置的质量变化关系如下表所示。
|
装置 |
A(试管+粉末) |
B |
C |
|
反应前 |
42.0 g |
75.0 g |
140.0 g |
|
反应后 |
37.0 g |
79.0 g |
140.5 g |

请通过计算,推断出该实验条件下硫酸铜分解的化学方程式。
(4)硫化钠是用于皮革的重要化学试剂,可用无水Na2SO4与炭粉在高温下反应制得,化学方程式如下:
①Na2SO4
+ 4C Na2S + 4CO↑ ②Na2SO4
+ 4CO
Na2S + 4CO↑ ②Na2SO4
+ 4CO Na2S + 4CO2
Na2S + 4CO2
a.若在反应过程中,产生CO和CO2混合气体为2mol,求生成Na2S的物质的量。
b.硫化钠晶体放置在空气中,会缓慢氧化成Na2SO3,甚至是Na2SO4,现将43.72g部分变质的硫化钠样品溶于水中,加入足量盐酸后,过滤得4.8g沉淀和1.12L H2S 气体(标准状况,假设溶液中气体全部逸出),在滤液中加入足量的BaCl2后过滤得2.33g沉淀,分析该硫化钠样品的成分及其物质的量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com