
| A. | 原子半径:Na>Al | |
| B. | 若把铝钠合金投入一定量的水中只得到无色溶液,则n(Al)≤n(Na) | |
| C. | m g不同组成的铝钠合金投入足量盐酸中,若放出H2越多,则铝的质量分数越小 | |
| D. | 铝钠合金投入到足量氯化铜溶液中,肯定有氢氧化铜沉淀生成 |
分析 A.根据同一周期从左到右,元素原子半径逐渐减小;
B.钠和水反应生成的氢氧化钠,足量的氢氧化钠将金属铝溶解;
C.金属钠和金属铝和酸反应生成氢气量的关系:2Al~3H2↑,2Na~H2↑,等质量的金属钠和金属铝,则金属Al产生的氢气量多,所以放出的H2越多,则铝的质量分数越大;
D.铝能与氯化铜溶液反应置换出铜.
解答 解:A.元素周期表中Na、Al位于同周期,Na的原子序数小于Al,故原子半径:Na>Al,故A正确;
B.Na与H2O反应生成NaOH和H2,Al与NaOH反应生成NaAlO2和H2,关系式为Na~NaOH~Al,得到无色溶液,说明Na、Al全部溶解,n(Al)≤n(Na),故B正确;
C.失去1 mol电子(产生$\frac{1}{2}$ mol H2),消耗Na为23 g,而消耗 Al为9 g,故相同质量的Na、Al,后者放出氢气较多,在合金中Al的质量分数越高,放出的氢气就越多,故C错误;
D.铝钠合金投入到足量氯化铜溶液中,钠和水反应2Na+2H2O=2NaOH+H2↑,生成的氢氧化钠可以和氯化铜反应生成氢氧化铜沉淀,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,若n(Al)>n(Na),金属铝也可能会置换出氯化铜中的金属铜,故D正确.
故选C.
点评 本题主要考查了金属的化学性质,把握反应原理及反应与现象的关系为解答的关键,注意从实验的评价性及物质性质分析解答,题目难度不大.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 硝酸银溶液跟铜反应 Cu+Ag+=Cu2++Ag | |
| B. | 铁粉跟稀盐酸反应 2Fe+6H+=2Fe3++3H2↑ | |
| C. | 钠跟水反应 2 Na+2H2O=2 Na++2OH-+H2↑ | |
| D. | 碳酸钙跟盐酸反应CO32-+2H+=H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KNO3溶液 | B. | NaCl溶液 | C. | 铜粉 | D. | 硫酸铜晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
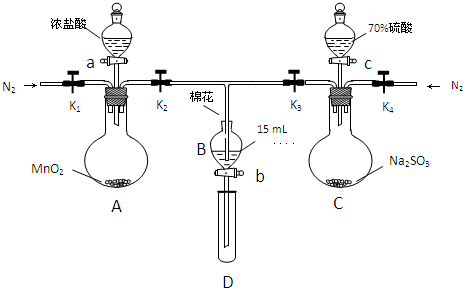
| 过程ⅣB溶液中含有的离子 | 过程ⅥB溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
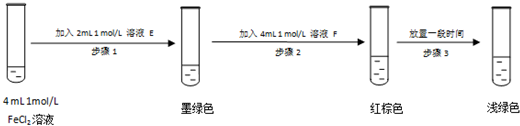
 Fe(OH)3+3H+和SO32-+H2O
Fe(OH)3+3H+和SO32-+H2O  HSO32-+OH-逆向进行,溶液变为浅绿色.
HSO32-+OH-逆向进行,溶液变为浅绿色.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
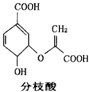
| A. | 可与乙醇、乙酸反应,且反应类型相同 | |
| B. | 1 mo1分枝酸最多可与3 mol NaOH发生中和反应 | |
| C. | 分枝酸的分子式为C10H8O6 | |
| D. | 分枝酸分子中含有2种官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
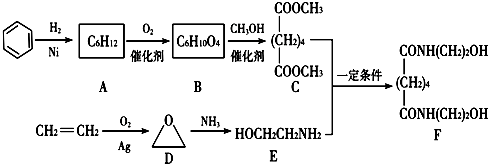
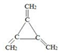 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加稀盐酸,将产生的无色气体通入澄清石灰水中,石灰水变浑浊,则原溶液中一定有CO32-或HCO3- | |
| B. | 向某溶液中加入硝酸钡溶液有白色沉淀产生,再加稀盐酸,沉淀不消失,则原溶液中一定有SO42- | |
| C. | 向某溶液中加入浓氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,则原溶液中存在NH4+ | |
| D. | 分别含有Mg2+、Cu2+、Fe2+和Na+的四种盐溶液,只用NaOH溶液不能一次性鉴别出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子键就是使阴、阳离子结合成化合物的静电引力 | |
| B. | 在化合物CaCl2中,两个氯离子之间也存在离子键 | |
| C. | 分子中只有共价键的化合物一定是共价化合物 | |
| D. | 不同元素组成的多原子分子中的化学键一定为极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com