
| A. | NaCl和H2O2 | B. | H2O和NH3 | C. | CaF2和CsCl | D. | CCl4和HCl |
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,第IA、第IIA族和第VIA、第VIIA族元素之间易形成离子键.
解答 解:A.NaCl中钠离子和氯离子之间只存在离子键,H2O2中H原子和O原子之间和O原子与O原子之间只存在共价键,所以两者化学键类型不同,故A正确;
B.水分子中H原子和O原子之间只存在形成共价键,氨气分子中N原子和H原子之间只存在共价键,故B错误;
C.氟化钙中氟离子和钙离子之间只存在离子键,氯化铯中铯离子和氯离子之间只存在离子键,故C错误;
D.四氯化碳中碳原子和氯原子之间只存在共价键、HCl中氯原子和氢原子之间只存在共价键,故D错误;
故选A.
点评 本题考查了化学键的判断,明确离子键和共价键的区别是解本题关键,易错选项是C,注意氟化钙中两个氟离子之间不存在共价键,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 钠融化成银白色小球 | B. | 小球在液面上快速游动 | ||
| C. | 溶液底部出现银白色固体 | D. | 溶液变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠的电子式: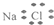 | B. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | ||
| C. | NH3的电子式: | D. | S2-的结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
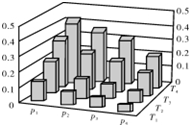
| A. | P1>P2>P3>P4 | |
| B. | 甲醇的物质的量分数越高,反应的平衡常数越大 | |
| C. | 若T1>T2>T3>T4,则该反应为放热反应 | |
| D. | 缩小容积,可以提高CH3OH在混合物中的质量分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
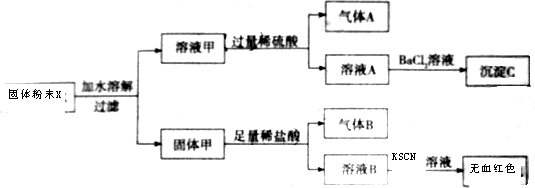
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | IO${\;}_{4}^{-}$作氧化剂 | |
| B. | 氧化性:Mn2+>IO${\;}_{3}^{-}$ | |
| C. | 氧化剂与还原剂的物质的量之比为5:2 | |
| D. | 若有2mol Mn2+参加反应,则转移10mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com