
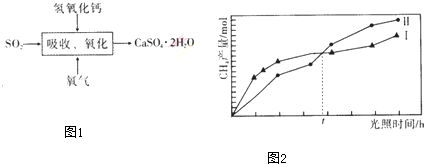
分析 (1)煤的加工分为干馏、气化和液化,煤的液化分为直接液化和间接液化;
(2)逆流通人惰性气体增大接触面积,充分进行热交换,故答案为:充分进行热交换;
(3)根据反应的关系式:S~SO2~H2SO4计算生成硫酸的质量,进而计算98%浓硫酸的质量;
(4)根据工艺图可知,SO2被氧气在Ca(OH)2存在的环境下氧化为石膏CaSO4•2H2O,据此写出化学方程式,从石灰石浆液的成本较熟石灰低;
(5)根据反应物为CO2和H2O(g)产物为CH4和O2来书写化学方程式;催化剂受光照时间的影响.
解答 解:(1)煤的加工分为干馏、气化和液化,煤的液化分为直接液化和间接液化,煤的直接液化是将煤在氢气和催化剂作用下通过加氢裂化转变为液体燃料的过程,因过程主要采用加氢手段,故又称煤的加氢液化法,煤的间接液化是先把煤炭在高温下与氧气和水蒸气反应,使煤炭全部气化、转化成合成气(一氧化碳和氢气的混合物),然后再在催化剂的作用下合成为液体燃料的工艺技术,故答案为:气化,直接液化技术;间接液化技术;!
(2)逆流通人惰性气体可充分进行热交换,
(3)每天燃烧掉的烟煤中S的质量=200t×1.6%=3.2t,
S~SO2~H2SO4
32 98
3.2t×360 m(H2SO4)
m(H2SO4)=$\frac{3.2t×360×98}{32}$=3528t,
故得到98%的浓硫酸的质量为:$\frac{3528t}{98%}$=3600t,
故答案为:3600t;
(4)根据工艺图可知,SO2被氧气在Ca(OH)2存在的环境下氧化为石膏CaSO4•2H2O,故化学方程式为:2SO2+O2+2Ca(OH)2+4H2O=2CaSO4•2H2O,而由于石灰石浆液的成本较熟石灰低,故使用石灰石浆液而不用熟石灰,故答案为:2SO2+O2+2Ca(OH)2+4H2O=2CaSO4•2H2O,石灰石浆液的成本较熟石灰低;
(5)根据反应物为CO2和H2O(g)产物为CH4和O2可知化学方程式为:CO2+2H2O(g)$\frac{\underline{\;催化剂\;}}{光照}$CH4+2O2;光照t小时后催化剂Ⅱ作用下CH4的产量开始高于催化剂I,说明光照能提高催化剂的活性,故答案为:CO2+2H2O(g)$\frac{\underline{\;催化剂\;}}{光照}$CH4+2O2;催化剂的活性受光照时间的影响.
点评 本题考查了煤的综合利用和化学方程式的书写,综合性较强,应注意的是煤的综合利用是高频考点.


科目:高中化学 来源: 题型:选择题
| A. | KOH中含有离子键也含有共价键,属于离子化合物 | |
| B. | HCl中存在离子键,属于离子化合物 | |
| C. | 含有共价键的化合物一定是共价化合物 | |
| D. | 阴、阳离子间通过静电引力而形成的化学键叫做离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑩ | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
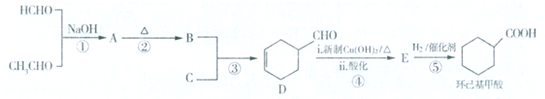
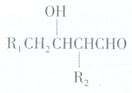 或
或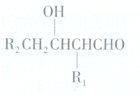
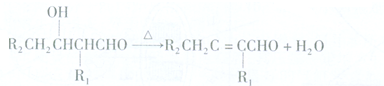
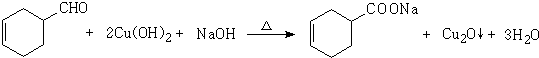 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用分液法分离碘酒和CCl4 | |
| B. | 用饱和碳酸钠溶液萃取乙醇中的乙酸 | |
| C. | 用银氨溶液鉴别甲酸乙酯和乙醛 | |
| D. | 用浓溴水鉴别苯和环己烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
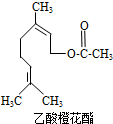 乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中不正确的是( )
乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中不正确的是( )| A. | ①②③ | B. | ①②⑤ | C. | ①②⑤⑥ | D. | ③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
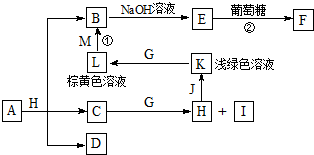 各物质之间的转化关系如图,部分生成物省略.C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10.D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷线路板.
各物质之间的转化关系如图,部分生成物省略.C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10.D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷线路板. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
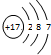 ,关于该粒子的说法不正确的是( )
,关于该粒子的说法不正确的是( )| A. | 核电荷数为17 | B. | 该粒子的化学式为Cl- | ||
| C. | 元素的最低化合价为-1 | D. | 与活泼金属反应时容易得电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
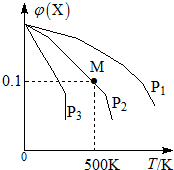 某可逆反应为2X(g)═3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示:下列推断正确的是( )
某可逆反应为2X(g)═3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示:下列推断正确的是( )| A. | 升高温度,该反应平衡常数K减小 | B. | 压强大小有P3>P2>P1 | ||
| C. | 平衡后加入高效催化剂使Mr增大 | D. | 在该条件下M点X平衡转化率为$\frac{9}{11}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com