
3,5二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:
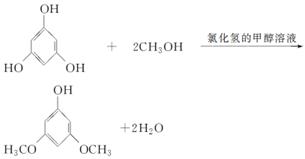
甲醇、乙醚和3,5二甲氧基苯酚的部分物理性质见下表:
| 物质 | 沸点/℃ | 熔点/℃ | 密度(20 ℃) /g·cm-3 | 溶解性 |
| 甲醇 | 64.7 | — | 0.791 5 | 易溶于水 |
| 乙醚 | 34.5 | — | 0.713 8 | 微溶于水 |
| 3,5二甲氧基苯酚 | — | 33~36 | — | 易溶于甲醇、乙醚,微溶于水 |
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取。①分离出甲醇的操作是________________。②萃取用到的分液漏斗使用前需________并洗净,分液时有机层在分液漏斗的________(填“上”或“下”)层。
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和NaHCO3溶液洗涤的目的是________;用饱和食盐水洗涤的目的是_______________。
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是________(填字母)。
a.蒸馏除去乙醚 b.重结晶
c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤。为了防止倒吸,减压过滤完成后应先________,再________。
答案 (1)①蒸馏 ②检查是否漏水 上
(2)除去HCl 除去少量NaHCO3且减少产物损失
(3)dcab
(4)拆去连接抽气泵和吸滤瓶的橡皮管 关闭抽气泵
解析 (1)甲醇和3,5二甲氧基苯酚是互溶的,可以利用两者的沸点不同,用蒸馏的方法进行分离。使用分液漏斗时首先要对分液漏斗进行是否漏水的检查。由于乙醚的密度比水小,所以有机层在分液漏斗的上层。
(2)由于在合成时所用的是氯化氢的甲醇溶液,所以加NaHCO3溶液的目的是除去HCl,用饱和食盐水洗涤的目的是除去少量的NaHCO3杂质,同时可以减少3,5二甲氧基苯酚的损失。
(3)洗涤后,产物中仍混有H2O和乙醚,所以先加入无水CaCl2除去H2O,然后过滤除去CaCl2。通过蒸馏除去乙醚,最后重结晶得到纯净的3,5二甲氧基苯酚。所以操作顺序为dcab。
(4)倒吸主要是由于压强减小造成的,所以为了防止倒吸,结束时应先拆去连接抽气泵和吸滤瓶的橡皮管,最后再关闭抽气泵。


科目:高中化学 来源: 题型:
下列说法正确的是( )
 A.矿泉水中含有多种微量元素,经常饮用有益身体健康
A.矿泉水中含有多种微量元素,经常饮用有益身体健康
 B.营养强化剂吃的越多越好
B.营养强化剂吃的越多越好
 C.合理选择饮食,正确使用药物是人体健康的保证
C.合理选择饮食,正确使用药物是人体健康的保证
 D.大部分药物都无毒副作用,都是非处方药
D.大部分药物都无毒副作用,都是非处方药
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中错误的是( )
A.温度越高,酶的催化活性越强
B.用灼烧的方法可以鉴别毛织物和棉织物
C.在豆浆中加入少量的石膏,能使豆浆凝结为豆腐
D.浓硝酸使皮肤呈黄色是由于浓硝酸与蛋白质发生了颜色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应I2(s)+Cl2(g)===2ICl(l),实验室用如图所示装置制取少量ICl(加热、夹持仪器已略去)。
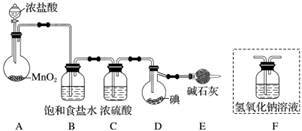
已知:ICl的熔点为13.9 ℃,沸点为97.4 ℃,易水解,且能发生反应:ICl(l)+Cl2(g)===ICl3(l)。
(1)装置A中发生反应的化学方程式是_________________________________________。
(2)装置B的作用是________________。不能用装置F代替装置E,理由是________________________________________________________________________。
(3)所制得的ICl中溶有少量ICl3杂质,提纯的方法是________(填字母)。
A.过滤 B.蒸发结晶
C.蒸馏 D.分液
(4)用ICl的冰醋酸溶液测定某油脂的不饱和度。进行如下两个实验,实验过程中有关反应为
①CC+ICl,CICCl
②ICl+KI===I2+KCl
③I2+2Na2S2O3===2NaI+Na2S4O6
实验一:将0.500 g该油脂样品溶于10 mL四氯化碳后,加入20 mL某ICl的冰醋酸溶液(过量),充分反应后,加入足量KI溶液,生成的碘单质用a mol·L-1的Na2S2O3标准溶液滴定,经平行实验,测得消耗的Na2S2O3溶液的平均体积为V1 mL。
实验二(空白实验):不加油脂样品,其他操作步骤、所用试剂及用量与实验一完全相同,测得消耗的Na2S2O3溶液的平均体积为V2 mL。
①滴定过程中可用________作指示剂。
②滴定过程中需要不断振荡,否则会导致 V1________(填“偏大”或“偏小”)。
③0.500 g该油脂样品所消耗的ICl的物质的量为______ mol。由此数据经换算即可求得该油脂的不饱和度。
查看答案和解析>>
科目:高中化学 来源: 题型:
4,7二甲基香豆素(熔点132.6 ℃)是一种重要的香料,广泛分布于植物界中,以间甲苯酚为原料的合成反应如下:

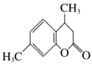 +C2H5OH+H2O
+C2H5OH+H2O
4,7二甲基香豆素
实验装置图如下:

主要实验步骤:
步骤1:向三颈烧瓶中加入60 mL浓硫酸,并冷却至0 ℃以下,边搅拌边滴入间甲苯酚30 mL(0.29 mol)和乙酰乙酸乙酯26.4 mL(0.21 mol)的混合物。
步骤2:保持在10 ℃下,搅拌12 h,反应完全后,将其倒入冰水混合物中,然后抽滤、水洗得粗品。
步骤3:粗品用乙醇溶解并重结晶,得白色针状晶体并烘干,称得产品质量为33.0 g。
(1)图中仪器名称:a____________,b____________。
(2)浓H2SO4需要冷却至0 ℃以下的原因是____________________________________
________________________________________________________________________。
(3)反应需要搅拌12 h,其原因是___________________________________________
________________________________________________________________________。
(4)确定最终产品是4,7二甲基香豆素的实验或方法是____________________。
(5)本次实验产率为____________。
答案 (1)恒压滴液漏斗 吸滤瓶
(2)防止浓硫酸将有机物氧化和炭化
(3)使反应物充分接触,提高反应速率
(4)测量熔点或测定其红外(紫外)光谱(及核磁共振氢谱)等 (5)89%
查看答案和解析>>
科目:高中化学 来源: 题型:
在某100mL混合液中,HNO3和H2SO4的物质的量浓度分别是0.4mol·L-1和0.1mol·L-1。向该混合液中加入1.92g铜粉,加热,待充分反应后,所得溶液中的Cu2+的物质的量浓度(mol·L-1)是: ( )
A.0.15 B.0.225 C.0.35 D.0.45
查看答案和解析>>
科目:高中化学 来源: 题型:
6.4 g铜与过量的硝酸(8 mol·L-1 60 mL)充分反应后,硝酸的还原产物有NO、NO2,反应后溶液中含H+为n mol,此时溶液中含NO3-的物质的量为( )
A.0.28 mol B.0.31 mol
C.(n+0.2) mol D.(n+0.4)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
 下列离子方程式正确的是( )
下列离子方程式正确的是( )
 A.澄清石灰水与盐酸反应:H+ + OH- = H2O
A.澄清石灰水与盐酸反应:H+ + OH- = H2O
 B.把金属铁放入稀H2SO4中反应:2Fe + 6H+ = 2Fe3+ + 3H2 ↑
B.把金属铁放入稀H2SO4中反应:2Fe + 6H+ = 2Fe3+ + 3H2 ↑
 C.H2SO4与Ba(OH)2溶液反应:Ba2+ + H+ + OH-+ SO42—= BaSO4↓+ H2O
C.H2SO4与Ba(OH)2溶液反应:Ba2+ + H+ + OH-+ SO42—= BaSO4↓+ H2O
 D.AlCl3溶液中加入过量的浓氨水:Al3+ + 4NH3·H2O = AlO2-+ 4NH4+ + 2H2O
D.AlCl3溶液中加入过量的浓氨水:Al3+ + 4NH3·H2O = AlO2-+ 4NH4+ + 2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com