
分析 电解质:在水溶液中或熔融状态下能导电的化合物;例:酸、碱、盐,金属氧化物等.非电解质:在水溶液中或熔融状态下不能导电的化合物;例:有机物,非金属氧化物等.
解答 解:A、稀硫酸能导电,属于混合物,既不是电解质也不是非电解质;
B、铜能导电,属于金属单质,既不是电解质也不是非电解质;
C、金刚石不能导电,属于非金属单质,既不是电解质也不是非电解质;
D、熔融NaCl能导电,属于盐,是电解质;
E、NH3 不能导电,溶于水导电的原因是氨气与水反应生成了一水合氨,氨气是非电解质;
F、Na2O不能导电,熔融状态下能导电,属于电解质;
G、酒精不能导电,属于非电解质;
H、SO3不能导电,溶于水导电的原因是三氧化硫与水反应生成了硫酸,硫酸属于电解质,三氧化硫是非电解质;
I、HCl不能导电,溶于水或熔融状态下能导电,属于电解质;
J、空气不能导电,属于混合物,既不是电解质也不是非电解质,故答案为:(1)DFI;(2)EGH;(3)ABD.
点评 本题考查了电解质、非电解质的判断,难度不大,根据定义判断即可,注意不是电解质的物质不一定是非电解质,如单质和混合物.


科目:高中化学 来源: 题型:解答题
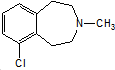 )一种治疗心血管和高血压的药物,可由化合物B(
)一种治疗心血管和高血压的药物,可由化合物B( )通过以下路线合成:
)通过以下路线合成: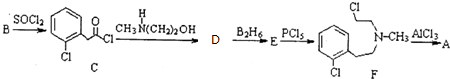
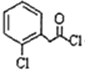 +CH3NH(CH2)2OH→
+CH3NH(CH2)2OH→ +HCl.
+HCl. .由F生成A的反应类型为取代反应.
.由F生成A的反应类型为取代反应. 或
或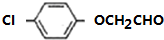 .
.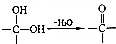 .写出以
.写出以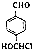 为原料制备化合物
为原料制备化合物 的合成路线流程图.
的合成路线流程图. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
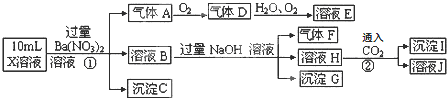
| A. | 气体F不能与溶液E发生反应 | |
| B. | X中肯定存在Fe2+、Al3+、NH4+、SO42- | |
| C. | X中肯定不存在CO32-、SO32-、Cl- | |
| D. | X中不能确定的离子是Al3+和Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
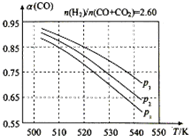 甲醇是重要的化工原料,又可做为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
甲醇是重要的化工原料,又可做为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:| 物质 | CO | CO2 | H2 | CH3OH(g) |
| 标准生成热(kJ/mol) | -110.52 | -393.51 | 0 | -201.25 |
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |||
| CH3OH(g) | CH3OCH3(g) | H2O(g) | CH3OCH3(g) | H2O(g) | ||
| a | 387 | 0.20 | 0 | 0 | 0.080 | 0.080 |
| b | 387 | 0.40 | 0 | 0 | ||
| c | 207 | 0.20 | 0 | 0 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、H+、Al3+、CH3COO- | B. | Mg2+、HCO3-、Ca2+、NO3- | ||
| C. | K+、SO42-、Cl-、Cu2+ | D. | NH4+、Cl-、K+、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com