
| A. | 原子半径:X<W<Z<Y | |
| B. | 简单氢化物的稳定性:X>W>Z | |
| C. | 氢元素与W、X形成的相对分子质量最小的酸分子式为H2WX3 | |
| D. | X与Y形成的两种二元化合物中,阴、阳离子数之比均为1:2 |
分析 短周期元素W、X、Y、Z的原子序数依次增大,Z的单质可用作太阳能也池的光电转换材料,Z为Si,W、Z同主族,W为C;X2-与Y+离子的电子层结构相同,则X为O,Y为Na,然后结合元素周期律及元素化合物知识来解答.
解答 解:由上述分析可知,W为C,X为O,Y为Na,Z为Si,
A.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径:X<W<Z<Y,故A正确;
B.非金属性越强,对应氢化物越稳定,则简单氢化物的稳定性:X>W>Z,故B正确;
C.氢元素与W、X形成的相对分子质量最小的酸为HCOOH,分子式为分子式为H2WX2,故C错误;
D.X与Y形成的两种二元化合物为Na2O或Na2O2,阴、阳离子数之比均为1:2,故D正确;
故选C.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素化合物知识、元素的位置、原子结构来推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
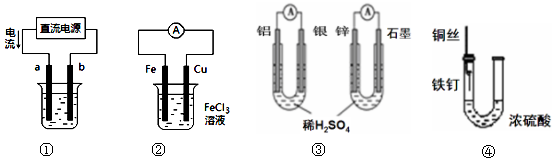
| A. | 用装置①精炼铜,则a极为粗铜,b为精铜,电解质溶液为CuSO4溶液 | |
| B. | 装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+ | |
| C. | 图③两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同 | |
| D. | 装置④中的铁钉几乎没被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在中和热测定实验中,将碱缓慢倒入酸中,以确保酸碱充分反应 | |
| B. | 为除去蛋白质溶液中混有的(NH4)2SO4,将混合物装入半透膜袋,并放入流动的蒸馏水中 | |
| C. | 用排水集气法收集气体,能验证铜与稀硝酸的反应产物是NO | |
| D. | 向硝酸银溶液中先滴加少量氯化钠溶液,再加少量硫化钾溶液,试管中先有白色沉淀,后有黑色沉淀,则AgCl的溶解度大于Ag2S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
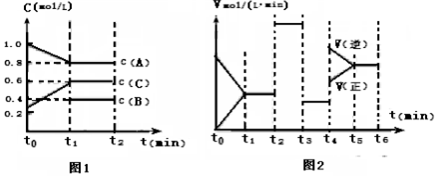
| 时间段 | t1~t2 | t2~t3 | t3~t4 | t5~t6 |
| 平衡常数 | K1 | K2 | K3 | K4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 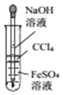 用所示装置制取并观察Fe(OH)2 | |
| B. | 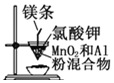 用所示装置制取金属锰 | |
| C. | 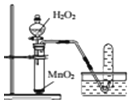 用所示装置制取干燥的O2 | |
| D. | 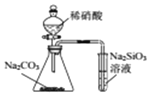 用所示装置比较N、C、Si的非金属性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 黑火药的使用 | B. | 用铁矿石炼铁 | ||
| C. | 打磨磁石制备指南针 | D. | 造纸术的使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
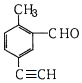
| A. | 能使酸性KMnO4溶液褪色 | |
| B. | 与新制氢氧化铜悬浊液加热煮沸产生砖红色沉淀 | |
| C. | 1mol该物质和H2反应,最多消耗5molH2 | |
| D. | 苯环上的一氯代物有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com