
| A. | 7.1g氯气与足量的氢氧化钠溶液反应转移的电子数为0.2×6.02×1023 | |
| B. | 50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| C. | 0.1molNa2O2与足量二氧化碳充分反应转移的电子数为0.2NA | |
| D. | 0.1molFe在0.1mol氯气中燃烧,转移的电子数为0.2NA |
分析 A.氯气与氢氧化钠溶液的反应中,氯气既是氧化剂又是还原剂;
B.浓盐酸与二氧化锰的反应加入生成氯气,而稀盐酸不与氯气反应,浓盐酸变成稀盐酸后反应停止;
C.0.1mol过氧化钠与足量二氧化碳反应生成0.05mol氧气,结合过氧化钠中氧元素的化合价为-1价分析转移电子的物质的量及数目;
D.氯气不足,转移分子数按照氯气的物质的量计算.
解答 解:A.7.1g氯气的物质的量为:$\frac{7.1g}{71g/mol}$=0.1mol,0.1mol氯气与足量的氢氧化钠溶液反应时转移了0.1mol电子,转移的电子数为0.1×6.02×1023,故A错误;
B.50ml 12mol/L盐酸中含有0.6molHCl,由于稀盐酸不与二氧化锰反应,则反应生成的氯气小于0.15mol,反应转移电子的物质的量小于0.3mol,转移的电子数小于0.3NA,故B错误;
C.0.1molNa2O2与足量二氧化碳充分反应生成0.05mol氧气,转移了0.1mol电子,转移的电子数为0.1NA,故C错误;
D.0.1molFe在0.1mol氯气中燃烧,氯气不足,0.1mol氯气完全反应得到0.2mol电子,转移的电子数为0.2NA,故D正确;
故选D.
点评 本题考查阿伏加德罗常数,侧重考查氧化还原反应,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题有利于培养学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生石灰-Ca(OH)2 | B. | 石膏-Na2SO4•10H2O | ||
| C. | 水玻璃-Na2SiO3水溶液 | D. | 纯碱-NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在水溶液中:H+、I-、NO3-、SiO32- | |
| B. | 饱和氯水中:Cl-、NO3-、Na+、SO3- | |
| C. | 将足量CO2通入时:H+、NH4+、Al3+、SO42- | |
| D. | 加入金属铝产生H2的溶液中:NH4+、Na+、SO42-、CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 组 分 | SiO2 | C | Na2O | K2O | Al2O3 | Fe2O3 |
| 质量分数 | 59.20 | 38.80 | 0.25 | 0.50 | 0.64 | 0.16 |
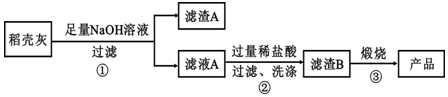
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 moI/L的CH3COOH溶液的pH=2.1 | |
| B. | 等pH等体积的盐酸、CH3COOH溶液和足量锌反应,CH3COOH放出的氢气较多 | |
| C. | 用CH3COOH溶液做导电实验,灯泡很暗 | |
| D. | 0.1 moI/L的CH3COOH溶液稀释100倍,pH<3. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlN中氮元素的化合价为+3 | |
| B. | 上述反应中,N2是还原剂,Al2O3是氧化剂 | |
| C. | 上述反应中,每生成1molAlN需转移6mol电子 | |
| D. | AlN与NaOH溶液反应的化学方程式为:AlN+NaOH+H2O=NaAlO2+NH3↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 漂白粉的有效成分是Ca(ClO)2 | |
| B. | 漂白粉暴露在空气中久置不会变质 | |
| C. | 漂白粉是由Cl2与石灰乳制得 | |
| D. | 漂白粉变质过程中不涉及氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
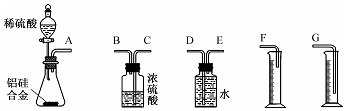
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com