
 能源问题是当前人类社会面临的一项重大课题,H2、CO、CH3OH都是重要的能源物质,它们的燃烧热依次为285.8kJ/mol、282.5kJ/mol、726.7kJ/mol.请回答:
能源问题是当前人类社会面临的一项重大课题,H2、CO、CH3OH都是重要的能源物质,它们的燃烧热依次为285.8kJ/mol、282.5kJ/mol、726.7kJ/mol.请回答:分析 (1)分别写出CO、H2、CH3OH热化学方程式后,根据盖斯定律就可得出要求的热化学方程式及反应热;
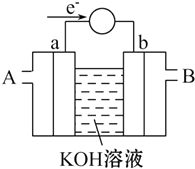
(2)①由电子转移方向可知a为负极,发生氧化反应,应通入燃料,b为正极,发生还原反应,应通入空气,以此解答该题.
解答 解:(1)CO燃烧的热化学方程式:CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-282.5 kJ•mol-1 ①
H2燃烧的热化学方程式:2H2(g)+O2(g)═2H2O(l)△H=-285.8×2 kJ•mol-1 ②
CH3OH燃烧的热化学方程式:CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-726.7 kJ•mol-1 ③
将①+②+(-③)可得:CO(g)+2H2(g)═CH3OH(l)△H=-127.4KJ•mol-1,
故答案为:CO(g)+2H2(g)=CH3OH(l)△H=-127.4kJ/mol;
(2)①由电子转移方向可知a为负极,发生氧化反应,应通入燃料,b为正极,发生还原反应,应通入空气,故答案为:B;
②假设使用的“燃料”是甲醇,a极为负极,发生的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O,b为正极,发生还原反应,电极方程式为O2+4e-+2H2O=4OH-,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
③假设使用的“燃料”是H2,则负极发生H2+2e-+2OH-=2H2O,用这种电池电镀铜,待镀金属增重6.4g,n(Cu)=$\frac{6.4g}{64g/mol}$=0.1mol,转移电子0.2mol,由电极方程式可知消耗0.1molH2,体积为2.24L,
故答案为:2.24L.
点评 本题考查的知识点较多,题目综合性较强,难度较大,主要考查了盖斯定律的应用、燃料电池等,在书写电池的电极方程式时要注意电解质对反应产物的影响.


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:解答题
 +H2$\stackrel{催化剂}{→}$
+H2$\stackrel{催化剂}{→}$ .写出C与NaOH水溶液共热反应的化学方程式
.写出C与NaOH水溶液共热反应的化学方程式 +3NaOH$→_{△}^{水}$
+3NaOH$→_{△}^{水}$ +2NaBr+H2O.
+2NaBr+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3 mol•L-1的Na2SO4溶液中含有Na+和SO42-的总物质的量为0.9 mol | |
| B. | 当1 L水吸收22.4 L氨气时所得氨水的浓度不是1 mol•L-1,只有当22.4 L氨气溶于水制得1 L氨水时,其浓度才是1 mol•L-1 | |
| C. | 在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相同 | |
| D. | 10℃时,100 mL 0.35 mol•L-1的KCl饱和溶液蒸发掉5g水,冷却到10℃时,其体积小于100 mL,它的物质的量浓度仍为0.35 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4的摩尔质量(g/mol)与NA个硫酸分子的质量(g)在数值上相等 | |
| B. | NA个氧气分子和NA个氮气分子的质量比为8:7 | |
| C. | 1mol•L-1 CaCl2溶液中所含Ca2+离子的数目为NA | |
| D. | 1mol D2(重氢分子)中含有2NA个中子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
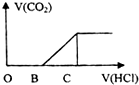 向某NaOH溶液中通入CO2气体后 得到溶液M,因CO2通入的量不同,溶液M的组成也不同,若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图所示.则下列分析与判断正确的是(不计CO2溶解)( )
向某NaOH溶液中通入CO2气体后 得到溶液M,因CO2通入的量不同,溶液M的组成也不同,若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图所示.则下列分析与判断正确的是(不计CO2溶解)( )| A. | 若OB=0,则溶液M为Na2CO3溶液 | |
| B. | 若OB=BC,则形成溶液M所发生反应的离子方程式为OH-+CO2═HCO3- | |
| C. | 若3OB=BC,则溶液M中c(NaHCO3)=2c(Na2CO3) | |
| D. | 若OB>BC,则溶液M中大量存在的阴离子为CO32-和HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com