
»Æѧ·“Ó¦ŌĄķŌŚ¹¤ŅµÉś²śÖŠ¾ßÓŠŹ®·ÖÖŲŅŖµÄŅāŅ唣
£Ø1£©ŗĻ³É°±ÓƵÄĒāĘųÓŠ¶ąÖÖÖĘČ”·½·Ø£ŗĒėÄ抓³öÓĆCÖʱøĖ®ĆŗĘųµÄ»Æѧ·“Ó¦·½³ĢŹ½ ”£»¹æÉŅŌÓÉĢģČ»Ęų»ņÖŲÓĶÖĘČ”ĒāĘų£ŗCH4£«H2O(g) øßĪĀ“߻ƼĮCO£«3H2£»±Č½ĻŅŌÉĻĮ½ÖÖ·½·Ø×ŖŅĘ6molµē×ÓŹ±£¬CŗĶCH4µÄÖŹĮæÖ®±ČŹĒ ”£
£Ø2£©¹¤ŅµÉś²śæÉŅŌÓĆNH3£Øg£©ÓėCO2£Øg£©¾¹żĮ½²½·“Ӧɜ³ÉÄņĖŲ£¬Į½²½·“Ó¦µÄÄÜĮæ±ä»ÆŹ¾ŅāĶ¼ČēĻĀ£ŗ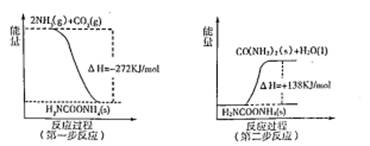
ŌņNH3£Øg£©ÓėCO2£Øg£©·“Ӧɜ³ÉÄņĖŲµÄČČ»Æѧ·½³ĢŹ½ĪŖ ”£
£Ø3£©ŅŃÖŖ·“Ó¦Fe£Øs£©+CO2£Øg£©£½FeO£Øs£©+CO£Øg£© ”÷H£½akJ/mol”£²āµĆŌŚ²»Ķ¬ĪĀ¶ČĻĀ£¬øĆ·“Ó¦µÄĘ½ŗā³£ŹżKĖęĪĀ¶ČµÄ±ä»ÆČēĻĀ£ŗ
¢ŁøĆ·“Ó¦µÄ»ÆŃ§Ę½ŗā³£Źż±ķ“ļŹ½K= £¬a 0£ØĢī”°>”±”¢”°<”±»ņ”°£ŗ”±£©”£ŌŚ500”ę2LĆܱÕČŻĘ÷ÖŠ½ųŠŠ·“Ó¦£¬FeŗĶCO2µÄĘšŹ¼Įæ¾łĪŖ4 mol£¬Ōņ5minŗó“ļµ½Ę½½ÖŹ±CO2µÄ×Ŗ»ÆĀŹĪŖ £¬Éś³ÉCOµÄĘ½¾łĖŁĀŹv£ØCO£©ĪŖ ”£
¢Ś700”ę·“Ó¦“ļµ½Ę½ŗāŗó£¬ŅŖŹ¹øĆĘ½ŗāĻņÓŅŅĘ¶Æ£¬ĘäĖūĢõ¼ž²»±äŹ±£¬æÉŅŌ²ÉČ”µÄ“ėŹ©ÓŠ £ØĢī×ÖÄø£©”£
| A£®ĖõŠ”·“Ó¦Ę÷ČŻ»ż | B£®Ōö¼ÓFeµÄĪļÖŹµÄĮæ |
| C£®ÉżøßĪĀ¶Čµ½900”ę | D£®Ź¹ÓĆŗĻŹŹµÄ“߻ƼĮ |
£Ø15·Ö£¬×īŗóŅ»ĪŹ1·Ö£¬ĘäÓąĆææÕ2·Ö£©£Ø1£©C£«H2O(g) CO£«H2£»9:4
£Ø2£©2NH3£Øg£©+CO2£Øg£©£½H2O£Øl£©+CO(NH2)2£Øs£© ”÷H£½£134kJ/mol
£Ø3£©¢Ł£»£¾£»50%£»0.2mol/(L”¤min) ¢ŚC
½āĪöŹŌĢā·ÖĪö£ŗ£Ø1£©øßĪĀĻĀĢ¼ŗĶĖ®ÕōĘų·“Ӧɜ³ÉĒāĘųŗĶCO£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ŹĒC£«H2O(g) CO£«H2£»·“Ó¦ÖŠĢ¼µÄ»ÆŗĻ¼Ū“Ó0¼ŪÉżøßµ½£«2¼Ū£¬×ŖŅĘ2øöµē×Ó”£Ņņ“Ė×ŖŅĘ6molµē×ÓŹ±£¬ĻūŗÄĢ¼µ„ÖŹµÄÖŹĮæŹĒ£ŗ12g/mol”Į3mol£½36g”£ŌŚ·“Ó¦CH4£«H2O(g) øßĪĀ“߻ƼĮCO£«3H2ÖŠĢ¼µÄ»ÆŗĻ¼Ū“Ó£4¼ŪÉżøßµ½£«2¼Ū£¬×ŖŅĘ6øöµē×Ó”£Ņņ“Ė×ŖŅĘ6molµē×ÓŹ±Ļūŗļ×ĶéµÄÖŹĮæŹĒ16g£¬ĖłŅŌŅŌÉĻĮ½ÖÖ·½·Ø×ŖŅĘ6molµē×ÓŹ±£¬CŗĶCH4µÄÖŹĮæÖ®±ČŹĒ36:16£½9:4”£
£Ø2£©øł¾ŻĶ¼ĻńæÉÖŖ£¬µŚŅ»²½·“Ó¦ÖŠ·“Ó¦ĪļµÄ×ÜÄÜĮæøßÓŚÉś³ÉĪļµÄ×ÜÄÜĮ棬Ņņ“ĖŹĒ·ÅČČ·“Ó¦£¬·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ŹĒ2NH3£Øg£©+CO2£Øg£©£½H2NCOONH4£Øl£¬°±»ł¼×Ėįļ§£© ”÷H1£½£272KJ/mol£»µŚ¶ž²½·“Ó¦ÖŠ£¬·“Ó¦ĪļµÄ×ÜÄÜĮæµĶÓŚÉś³ÉĪļµÄ×ÜÄÜĮ棬Ņņ“Ė·“Ó¦ŹĒĪüČČ·“Ó¦£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ŹĒH2NCOONH4£Øl£©£½H2O£Øl£©+ CO(NH2)2£Øs£© ”÷H2£½£«138KJ/mol”£øł¾ŻøĒĖ¹¶ØĀÉæÉÖŖ£¬Į½øö¹ż³ĢĻą¼Ó¼“µĆµ½NH3£Øg£©ÓėCO2£Øg£©·“Ӧɜ³ÉÄņĖŲµÄČČ»Æѧ·½³ĢŹ½£¬¼“ĪŖ2NH3£Øg£©+CO2£Øg£©£½H2O£Øl£©+ CO(NH2)2£Øs£© ”÷H£½£272KJ/mol£«138KJ/mol£½£134kJ/mol”£
£Ø3£©¢Ł»ÆŃ§Ę½ŗā³£ŹżŹĒŌŚŅ»¶ØĢõ¼žĻĀ£¬µ±æÉÄę·“Ó¦“ļµ½Ę½ŗāדĢ¬Ź±£¬Éś³ÉĪļÅØ¶ČµÄĆŻÖ®»żŗĶ·“Ó¦ĪļÅØ¶ČµÄĆŻÖ®»żµÄ±ČÖµ£¬ĖłŅŌøł¾Ż·“Ó¦Fe£Øs£©+CO2£Øg£©£½FeO£Øs£©+CO£Øg£©æÉÖŖ£¬øĆ·“Ó¦µÄĘ½ŗā³£ŹżK£½”£ÓɱķÖŠŹż¾ŻæÉÖŖ£¬¶ŌÓŚ·“Ó¦¢Ł£¬ĪĀ¶ČŌ½øßĘ½ŗā³£ŹżŌ½“ó£¬ĖµĆ÷ÉżøßĪĀ¶ČĘ½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ”£ÓÉÓŚÉżøßĪĀ¶ČĘ½ŗāĻņĪüČČ·“Ó¦·½Ļņ½ųŠŠ£¬¹Źa£¾0”£ĮīĘ½ŗāŹ±²Ī¼Ó·“Ó¦µÄ¶žŃõ»ÆĢ¼µÄĪļÖŹµÄĮæÅضČĪŖxmol£¬Ōņ£ŗ
Fe£Øs£©+CO2£Øg£©£½FeO£Øs£©+CO£Øg£©
ĘšŹ¼ÅØ¶Č£Ømol/L£© 2 0
×Ŗ»ÆĮæ£Ømol/L£© x x
Ę½ŗāĮæ£Ømol/L£© 2£x x
ĖłŅŌøł¾ŻĘ½ŗā³£ŹżµÄ±ķ“ļŹ½æÉÖŖ£½1£¬½āµĆx£½1£¬ĖłŅŌ¶žŃõ»ÆĢ¼µÄ×Ŗ»ÆĀŹĪŖ”Į100%£½50%”£ĘäÖŠCO±ķŹ¾µÄĘ½¾łĖŁĀŹv£ØCO£©£½£½0.2mol/£ØL?min£©”£
¢ŚA”¢·“Ó¦Ē°ŗóĢå»ż²»±ä£¬ĖõŠ”·“Ó¦Ę÷ČŻ»ż£¬Ń¹ĒæŌö“󣬻ÆŃ§Ę½ŗā²»ŅĘ¶Æ£¬¹ŹA“ķĪó£»
B”¢ĢśŹĒ¹ĢĢ壬Ōö¼ÓFeµÄĪļÖŹµÄĮ棬²»»įŅżĘš»ÆŃ§Ę½ŗāµÄŅĘ¶Æ£¬¹ŹB“ķĪó£»
C”¢Õż·½Ó¦ŹĒĪüČČ·“Ó¦£¬ÉżøßĪĀ¶Čµ½900”ę£¬»ÆŃ§Ę½ŗāÕżĻņŅĘ¶Æ£¬¹ŹCÕżČ·£»
D”¢“߻ƼĮÖ»ÄÜøı䷓ӦĖŁĀŹ£¬²»ÄÜøıäĘ½ŗāדĢ¬£¬ĖłŅŌŹ¹ÓĆŗĻŹŹµÄ“߻ƼĮ£¬²»»įŅżĘš»ÆŃ§Ę½ŗāµÄŅĘ¶Æ£¬¹ŹD“ķĪ󣬓š°øŃ”C”£
æ¼µć£ŗæ¼²éŃõ»Æ»¹Ō·“Ó¦·½³ĢŹ½µÄŹéŠ“ŗĶ¼ĘĖć£»ČČ»Æѧ·½³ĢŹ½µÄŹéŠ“£»»ÆŃ§Ę½ŗā³£ŹżµÄÓŠ¹ŲÓ¦ÓĆŗĶ¼ĘĖć£»Ķā½ēĢõ¼ž¶ŌĘ½ŗāדĢ¬µÄÓ°ĻģµČ


 ĆūŠ£æĪĢĆĻµĮŠ“š°ø
ĆūŠ£æĪĢĆĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
ÄæĒ°£¬Ļū³żµŖŃõ»ÆĪļĪŪČ¾ÓŠ¶ąÖÖ·½·Ø”£
£Ø1£©ÓĆCH4“߻ƻ¹ŌµŖŃõ»ÆĪļæÉŅŌĻū³żµŖŃõ»ÆĪļµÄĪŪČ¾”£ŅŃÖŖ£ŗ
¢ŁCH4(g)£«4NO2(g)£½4NO(g)£«CO2(g)£«2H2O(g) ¦¤H£½£574 kJ”¤mol£1
¢ŚCH4(g)£«4NO(g)£½2N2(g)£«CO2(g)£«2H2O(g) ¦¤H£½£1160 kJ”¤mol£1
¢ŪH2O(g)£½H2O(l) ¦¤H£½£44£®0 kJ”¤mol£1
Š“³öCH4 (g)ÓėNO2 (g)·“Ӧɜ³ÉN2 (g) ,CO2(g)ŗĶH2O(l)µÄČČ»Æѧ·½³Ģ Ź½_____________________
£Ø2£©ÓĆ»īŠŌĢ滹Ō·Ø“¦ĄķµŖŃõ»ÆĪļ”£ÓŠ¹Ų·“Ó¦ĪŖ£ŗC(s)£«2NO(g) N2(g)£«CO2(g)Ä³ŃŠ¾æŠ”×éĻņŗćČŻĆܱÕČŻĘ÷¼ÓČėŅ»¶ØĮæµÄ»īŠŌĢæŗĶNO£¬ŗćĪĀ£ØT”£C)Ģõ¼žĻĀ·“Ó¦£¬·“Ó¦½ųŠŠµ½²»Ķ¬Ź±¼ä²āµĆø÷ĪļÖŹµÄÅضČČēĻĀ
N2(g)£«CO2(g)Ä³ŃŠ¾æŠ”×éĻņŗćČŻĆܱÕČŻĘ÷¼ÓČėŅ»¶ØĮæµÄ»īŠŌĢæŗĶNO£¬ŗćĪĀ£ØT”£C)Ģõ¼žĻĀ·“Ó¦£¬·“Ó¦½ųŠŠµ½²»Ķ¬Ź±¼ä²āµĆø÷ĪļÖŹµÄÅضČČēĻĀ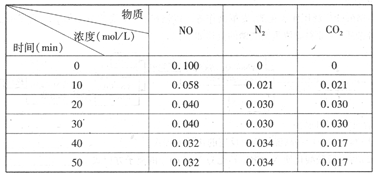
¢Ł²»ÄÜ×÷ĪŖÅŠ¶Ļ·“Ó¦“ļµ½»ÆŃ§Ę½ŗāדĢ¬µÄŅĄ¾Ż ŹĒ_______
A£®ČŻĘ÷ÄŚCO2µÄÅØ¶Č±£³Ö²»±ä
B£®vÕż£ØN2£©="2" vÕż£ØNO£©
C£®ČŻĘ÷ÄŚŃ¹Ēæ±£³Ö²»±ä
D£®»ģŗĻĘųĢåµÄĆܶȱ£³Ö²»±ä
E£®»ģŗĻĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ±£³Ö²»±ä
¢ŚŌŚT”£CŹ±£®øĆ·“Ó¦µÄĘ½ŗā³£ŹżĪŖ_______(±£ĮōĮ½Ī»Š”Źż)£»
¢ŪŌŚ30 min,øıäijŅ»Ģõ¼ž,·“Ó¦ÖŲŠĀ“ļµ½Ę½ŗā,ŌņøıäµÄĢõ¼žŹĒ_______
£Ø3£©æĘѧ¼ŅÕżŌŚŃŠ¾æĄūÓĆ“ß»Æ¼¼Źõ½«³¬ŅōĖŁ·É»śĪ²ĘųÖŠµÄNOŗĶCO×Ŗ±ä³ÉCO2ŗĶN2,Ęä·“Ó¦ĪŖ£ŗ
2CO£«2NO N2£«2CO2 ¦¤H<0ŃŠ¾æ±ķĆ÷£ŗŌŚŹ¹ÓƵČÖŹĮæ“߻ƼĮŹ±£¬Ōö“ó“߻ƼĮµÄ±Č±ķĆ껿æÉĢįøß»Æѧ·“Ó¦ĖŁĀŹ£®ĪŖĮĖ·Ö±šŃéÖ¤ĪĀ¶Č”¢“߻ƼĮµÄ±Č±ķĆ껿¶Ō»Æѧ·“ Ó¦ĖŁĀŹµÄÓ°Ļģ¹ęĀÉ”¢Ä³Ķ¬Ń§Éč¼ĘĮĖČż×鏵Ń飬²æ·ÖŹµŃéĢõ¼žŅŃ¾ĢīŌŚĻĀ±ķÖŠ”£
N2£«2CO2 ¦¤H<0ŃŠ¾æ±ķĆ÷£ŗŌŚŹ¹ÓƵČÖŹĮæ“߻ƼĮŹ±£¬Ōö“ó“߻ƼĮµÄ±Č±ķĆ껿æÉĢįøß»Æѧ·“Ó¦ĖŁĀŹ£®ĪŖĮĖ·Ö±šŃéÖ¤ĪĀ¶Č”¢“߻ƼĮµÄ±Č±ķĆ껿¶Ō»Æѧ·“ Ó¦ĖŁĀŹµÄÓ°Ļģ¹ęĀÉ”¢Ä³Ķ¬Ń§Éč¼ĘĮĖČż×鏵Ń飬²æ·ÖŹµŃéĢõ¼žŅŃ¾ĢīŌŚĻĀ±ķÖŠ”£
¢ŁÉĻ±ķÖŠ:a=_______,b=________,e=________
¢ŚĒėŌŚøų³öµÄ×ų±źĶ¼ÖŠ£¬»³öÉĻ±ķÖŠŹµŃéIIŗĶŹµŃéIIIĢõ¼žĻĀ»ģŗĻĘųĢåÖŠNOÅضČĖꏱ¼ä±ä»ÆµÄĒ÷ŹĘĒśĻßĶ¼,²¢±źĆ÷ĻąÓ¦µÄŹµŃ鱹ŗÅ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
Ö±½Ó¼×“¼Č¼ĮĻµē³Ų£ØDNFC£©±»ČĻĪŖŹĒ21ŹĄ¼Ķµē¶ÆĘū³µ×ī¼ŃŗņŃ”¶ÆĮ¦Ō“”£
£Ø1£©101 kPaŹ±£¬1 mol CH3OHĶźČ«Č¼ÉÕÉś³ÉĪČ¶ØµÄŃõ»ÆĪļ·Å³öČČĮæ726.51 kJ/mol£¬Ōņ¼×“¼Č¼ÉÕµÄČČ»Æѧ·½³ĢŹ½ĪŖ”””” ”””””” ”£
£Ø2£©¼×“¼ÖŹ×Ó½»»»Ä¤Č¼ĮĻµē³ŲÖŠ½«¼×“¼ÕōĘū×Ŗ»ÆĪŖĒāĘųµÄĮ½ÖÖ·“Ó¦ŌĄķŹĒ£ŗ
¢ŁCH3OH(g)+H2O(g)=CO2(g)+3H2(g) ”””÷H1="+49.0" kJ”¤mol-1
¢ŚCH3OH(g)+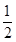 O2(g)= CO2(g)+2H2(g)”””÷H2
O2(g)= CO2(g)+2H2(g)”””÷H2
ŅŃÖŖH2(g)+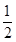 O2(g)=H2O(g)”””””÷H ="-241.8" kJ”¤mol-1
O2(g)=H2O(g)”””””÷H ="-241.8" kJ”¤mol-1
Ōņ·“Ó¦¢ŚµÄ”÷H2= ””””””””””””””””””””””””””kJ”¤mol-1”£
£Ø3£©¼×“¼Č¼ĮĻµē³ŲµÄ½į¹¹Ź¾ŅāĶ¼ČēÓŅ”£¼×“¼½ųČė”” ¼«£ØĢī”°Õż”±»ņ”°øŗ”±£©£¬Õż¼«·¢ÉśµÄµē¼«·“Ó¦Ź½ĪŖ”””””””””” ”””””” ”””””””””””£øŗ¼«·¢ÉśµÄµē¼«·“Ó¦Ź½ĪŖ”””””””””” ”” ”””””””””””””””£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĪŹ“šĢā
£Ø15·Ö£©
¼×“¼ŹĒŅ»ÖÖæÉŌŁÉśÄÜŌ“£¬¾ßÓŠ¹ć·ŗµÄæŖ·¢ŗĶÓ¦ÓĆĒ°¾°£®Ēė»Ų“šĻĀĮŠÓė¼×“¼ÓŠ¹ŲµÄĪŹĢā£®
£Ø1£©¼×“¼·Ö×ÓŹĒ____·Ö×Ó£ØĢī”°¼«ŠŌ”±»ņ”°·Ē¼«ŠŌ”±£©£®
£Ø2£©¹¤ŅµÉĻŅ»°ćæɲÉÓĆČēĻĀ·“Ó¦Ą“ŗĻ³É¼×“¼£ŗCO(g)+2H2(g) CH3OH(g)”÷H=-86.6kJ/mol£¬ŌŚT”ꏱ£¬ĶłŅ»øöĢå»ż¹Ģ¶ØĪŖ1LµÄĆܱÕČŻĘ÷ÖŠ¼ÓČė1mol COŗĶ2mol H2£ŗ£¬·“Ó¦“ļµ½Ę½ŗāŹ±£¬ČŻĘ÷ÄŚµÄŃ¹ĒæŹĒæŖŹ¼Ź±µÄ3/5£®
CH3OH(g)”÷H=-86.6kJ/mol£¬ŌŚT”ꏱ£¬ĶłŅ»øöĢå»ż¹Ģ¶ØĪŖ1LµÄĆܱÕČŻĘ÷ÖŠ¼ÓČė1mol COŗĶ2mol H2£ŗ£¬·“Ó¦“ļµ½Ę½ŗāŹ±£¬ČŻĘ÷ÄŚµÄŃ¹ĒæŹĒæŖŹ¼Ź±µÄ3/5£®
¢Ł“ļµ½Ę½ŗāŹ±£¬COµÄ×Ŗ»ÆĀŹĪŖ ”£
¢ŚĻĀĮŠŃ”ĻīÄÜÅŠ¶ĻøĆ·“Ó¦“ļµ½Ę½ŗāדĢ¬µÄŅĄ¾ŻµÄÓŠ____ ”£
A£® | B£®COµÄĻūŗÄĖŁĀŹµČÓŚCH3OHµÄÉś³ÉĖŁĀŹ |
| C£®ČŻĘ÷ÄŚµÄŃ¹Ēæ±£³Ö²»±ä | D£®»ģŗĻĘųĢåµÄĆܶȱ£³Ö²»±ä |
 £Ø3£©ŅŃÖŖŌŚ³£ĪĀ³£Ń¹ĻĀ£ŗ
£Ø3£©ŅŃÖŖŌŚ³£ĪĀ³£Ń¹ĻĀ£ŗ

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĪŹ“šĢā
SO2”¢NO”¢NO2”¢CO¶¼ŹĒĪŪČ¾“óĘųµÄÓŠŗ¦ĘųĢ壬¶ŌĘä½ųŠŠ»ŲŹÕĄūÓĆŹĒ½ŚÄܼõÅŵÄÖŲŅŖæĪĢā”£
£Ø1£©ÉĻŹöĖÄÖÖĘųĢåÖŠÖ±½ÓÅÅČėæÕĘųŹ±»įŅżĘšĖįÓźµÄÓŠ__________£ØĢī»ÆѧŹ½£©”£
£Ø2£©ŅŃÖŖ£ŗ2SO2(g)+ O2(g)=2SO3(g)£»”÷H=£196.6kJ/mol
O2(g)+2NO(g)=2NO2(g)£»”÷H=£113.0kJ/mol
¢Ł·“Ó¦£ŗNO2(g) +SO2(g)= SO3(g) +NO(g)µÄ”÷H=_ kJ/mol”£
¢ŚŅ»¶ØĢõ¼žĻĀ£¬½«NO2ŗĶSO2ŅŌĢå»ż±Č1£ŗ1ÖĆÓŚŗćĪĀŗćČŻµÄĆܱÕČŻĘ÷ÖŠ·¢Éś·“Ó¦£ŗ NO2(g) +SO2(g) SO3(g) +NO(g)£¬
SO3(g) +NO(g)£¬
ĻĀĮŠ²»ÄÜĖµĆ÷·“Ó¦“ļµ½Ę½ŗāדĢ¬µÄŹĒ_____£ØĢī×ÖÄø£©”£
a£®ĢåĻµŃ¹Ēæ±£³Ö²»±ä
b£®»ģŗĻĘųĢåµÄŃÕÉ«±£³Ö²»±ä
c£®NOµÄĪļÖŹµÄĮæ±£³Ö²»±ä
d£®ĆæÉś³É1molSO3µÄĶ¬Ź±ĻūŗÄ1molNO2
£Ø3£©COæÉÓĆÓŚŗĻ³É¼×“¼£¬Ęä·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖCO(g)+2H2(g)  CH3OH(g)”£ŌŚŅ»ČŻ»żæɱäµÄĆܱÕČŻĘ÷ÖŠ³äÓŠ10molCOŗĶ20mol H2£¬ŌŚ“߻ƼĮ×÷ÓĆĻĀ·¢Éś·“Ӧɜ³É¼×“¼”£COµÄĘ½ŗā×Ŗ»ÆĀŹ£Ø¦Į£©ÓėĪĀ¶Č£ØT£©”¢Ń¹Ēæ£Øp£©µÄ¹ŲĻµČēĶ¼ĖłŹ¾”£
CH3OH(g)”£ŌŚŅ»ČŻ»żæɱäµÄĆܱÕČŻĘ÷ÖŠ³äÓŠ10molCOŗĶ20mol H2£¬ŌŚ“߻ƼĮ×÷ÓĆĻĀ·¢Éś·“Ӧɜ³É¼×“¼”£COµÄĘ½ŗā×Ŗ»ÆĀŹ£Ø¦Į£©ÓėĪĀ¶Č£ØT£©”¢Ń¹Ēæ£Øp£©µÄ¹ŲĻµČēĶ¼ĖłŹ¾”£
¢ŁÉĻŹöŗĻ³É¼×“¼µÄ·“Ó¦ĪŖ______£ØĢī”°·ÅČČ”±»ņ”°ĪüČČ”±£©·“Ó¦”£
¢ŚA”¢B”¢CČżµćµÄĘ½ŗā³£ŹżKA”¢KB”¢KCµÄ“󊔹ŲĻµĪŖ___________”£
¢ŪČō“ļµ½Ę½ŗāדĢ¬AŹ±£¬ČŻĘ÷µÄĢå»żĪŖ10L£¬ŌņŌŚĘ½ŗāדĢ¬BŹ±ČŻĘ÷µÄĢå»żĪŖ_____L”£
£Ø4£©Ä³ŃŠ¾æŠ”×éÉč¼ĘĮĖČēĶ¼ĖłŹ¾µÄ¼×“¼Č¼ĮĻµē³Ų×°ÖĆ”£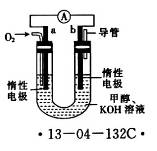
¢ŁøƵē³Ų¹¤×÷Ź±£¬OH-Ļņ______£ØĢī”°a”±»ņ”°b”±£©¼«ŅĘ¶Æ”£
¢Śµē³Ų¹¤×÷Ņ»¶ĪŹ±¼äŗ󣬲āµĆČÜŅŗµÄpH¼õŠ”£¬ŌņøƵē³Ų×Ü·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ__________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¼ĘĖćĢā
Ģ¼ŗĶĢ¼µÄ»ÆŗĻĪļŌŚÉś²ś”¢Éś»īÖŠµÄÓ¦ÓĆ·Ē³£¹ć·ŗ£¬ŌŚĢį³«½”æµÉś»īŅŃ³É³±Į÷µÄ½ńĢģ£¬”°µĶĢ¼Éś»ī”±²»ŌŁÖ»ŹĒŅ»ÖÖĄķĻė£¬øüŹĒŅ»ÖÖÖµµĆĘŚ“żµÄŠĀµÄÉś»ī·½Ź½”£
£Ø1£©½«CO2Óė½¹Ģæ×÷ÓĆÉś³ÉCO£¬COæÉÓĆÓŚĮ¶ĢśµČ”£
¢ŁŅŃÖŖ£ŗFe2O3(s)£«3C(ŹÆÄ«)£½2Fe(s)£«3CO(g) ¦¤H1£½ +489.0 kJ/mol
C(ŹÆÄ«)£«CO2(g)£½2CO(g) ¦¤H2£½+172.5 kJ/mol
ŌņCO»¹ŌFe2O3µÄČČ»Æѧ·½³ĢŹ½ĪŖ £»
¢ŚĀČ»ÆīŁ£ØPdCl2£©ČÜŅŗ³£±»Ó¦ÓĆÓŚ¼ģ²āæÕĘųÖŠĪ¢ĮæCO”£PdCl2±»»¹Ō³Éµ„ÖŹ£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ £»
£Ø2£©½«Į½øöŹÆÄ«µē¼«²åČėKOHČÜŅŗÖŠ£¬ĻņĮ½¼«·Ö±šĶØČėC3H8ŗĶO2¹¹³É±ūĶéČ¼ĮĻµē³Ų”£
¢Łøŗ¼«µē¼«·“Ó¦Ź½ŹĒ£ŗ £»
¢ŚÄ³Ķ¬Ń§ĄūÓƱūĶéČ¼ĮĻµē³ŲÉč¼ĘĮĖŅ»ÖÖµē½ā·ØÖĘČ”Fe(OH)2µÄŹµŃé×°ÖĆ£ØČēĻĀĶ¼ĖłŹ¾£©£¬Ķصēŗó£¬ČÜŅŗÖŠ²śÉś“óĮæµÄ°×É«³Įµķ£¬ĒŅ½Ļ³¤Ź±¼ä²»±äÉ«”£ĻĀĮŠĖµ·ØÖŠÕżČ·µÄŹĒ £ØĢīŠņŗÅ£©
A£®µēŌ“ÖŠµÄaŅ»¶ØĪŖÕż¼«£¬bŅ»¶ØĪŖøŗ¼«
B£®æÉŅŌÓĆNaClČÜŅŗ×÷ĪŖµē½āŅŗ
C£®A”¢BĮ½¶Ė¶¼±ŲŠėÓĆĢś×÷µē¼«
D£®Ņõ¼«·¢ÉśµÄ·“Ó¦ŹĒ£ŗ2H+£«2e££½H2”ü
£Ø3£©½«²»Ķ¬ĮæµÄCO(g)ŗĶH2O(g)·Ö±šĶØČėĢå»żĪŖ2LµÄŗćČŻĆܱÕČŻĘ÷ÖŠ£¬½ųŠŠ·“Ó¦£ŗCO(g)£«H2O(g)  CO2(g)£«H2(g)£¬µĆµ½ČēĻĀČż×鏿¾Ż£ŗ
CO2(g)£«H2(g)£¬µĆµ½ČēĻĀČż×鏿¾Ż£ŗ
| ŹµŃé×é | ĪĀ¶Č/”ę | ĘšŹ¼Įæ/mol | Ę½ŗāĮæ/mol | “ļµ½Ę½ŗāĖłŠčŹ±¼ä/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¼ĘĖćĢā
ĪŖ¼õŠ”CO2¶Ō»·¾³µÄÓ°Ļģ£¬ŌŚĻŽÖĘĘäÅÅ·ÅĮæµÄĶ¬Ź±£¬Ó¦¼ÓĒæ¶ŌCO2““ŠĀĄūÓƵÄŃŠ¾æ”£
£Ø1£©¢Ł°Ńŗ¬ÓŠ½ĻøßÅضČCO2µÄæÕĘųĶØČė±„ŗĶK2CO3ČÜŅŗ”£¢ŚŌŚ¢ŁµÄĪüŹÕŅŗÖŠĶØøßĪĀĖ®ÕōĘųµĆµ½øßÅØ¶ČµÄCO2ĘųĢ唣Š“³ö¢ŚÖŠ·“Ó¦µÄ»Æѧ·½³ĢŹ½__________________________”£
£Ø2£©Čē½«CO2ÓėH2ŅŌ1:3µÄĢå»ż±Č»ģŗĻ”£
¢ŁŹŹµ±Ģõ¼žĻĀŗĻ³ÉijĢžŗĶĖ®£¬øĆĢžŹĒ £ØĢīŠņŗÅ£©”£
| A£®ĶéĢž | B£®Ļ©Ģž | C£®Č²Ģž | D£®±½µÄĶ¬ĻµĪļ |
 CH3OH(g)+H2O(g) ”÷H=£49.0 kJ/mol”£²āµĆCO2(g)ŗĶCH3OH(g)µÄÅضČĖꏱ¼ä±ä»ÆČēĶ¼ĖłŹ¾”£
CH3OH(g)+H2O(g) ”÷H=£49.0 kJ/mol”£²āµĆCO2(g)ŗĶCH3OH(g)µÄÅضČĖꏱ¼ä±ä»ÆČēĶ¼ĖłŹ¾”£
| Čܽā¶Č£ØS£©/g | ČܶȻż£ØKsp£© | ||
| Ca(OH)2 | Ba(OH)2 | CaCO3 | BaCO3 |
| 0.16 | 3.89 | 2.9”Į10£9 | 2.6”Į10£9 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¼ĘĖćĢā
³żČ„ŌÓÖŹŗóµÄĖ®ĆŗĘųÖ÷ŅŖŗ¬H2”¢CO£¬ŹĒĄķĻėµÄŗĻ³É¼×“¼µÄŌĮĻĘų”£
£Ø1£©Éś²śĖ®ĆŗĘų¹ż³ĢÖŠÓŠŅŌĻĀ·“Ó¦£ŗ¢ŁC(s)+CO2(g) 2CO(g) ”÷H1£»
2CO(g) ”÷H1£»
¢ŚCO(g)+H2O(g) H2(g)+CO2(g) ”÷H2£»¢ŪC(s)+H2O(g)
H2(g)+CO2(g) ”÷H2£»¢ŪC(s)+H2O(g) CO(g)+H2(g) ”÷H3£»
CO(g)+H2(g) ”÷H3£»
ÉĻŹö·“Ó¦”÷H3Óė”÷H1”¢”÷H2Ö®¼äµÄ¹ŲĻµĪŖ ”£
£Ø2£©½«CH4×Ŗ»Æ³ÉCO£¬¹¤ŅµÉĻ³£²ÉÓĆ“ß»Æ×Ŗ»Æ¼¼Źõ£¬Ęä·“Ó¦ŌĄķĪŖ£ŗ2CH4(g)£«3O2(g) 4CO(g)£«4H2O(g) ”÷H=£1038kJ/mol”£¹¤ŅµÉĻŅŖŃ”ŌńŗĻŹŹµÄ“߻ƼĮ£¬·Ö±š¶ŌX”¢Y”¢ZČżÖ֓߻ƼĮ½ųŠŠČēĻĀŹµŃé£ØĘäĖūĢõ¼žĻąĶ¬£©£ŗ
4CO(g)£«4H2O(g) ”÷H=£1038kJ/mol”£¹¤ŅµÉĻŅŖŃ”ŌńŗĻŹŹµÄ“߻ƼĮ£¬·Ö±š¶ŌX”¢Y”¢ZČżÖ֓߻ƼĮ½ųŠŠČēĻĀŹµŃé£ØĘäĖūĢõ¼žĻąĶ¬£©£ŗ
¢ŁXŌŚ750”ꏱ“߻Ɗ§ĀŹ×īøߣ¬ÄÜŹ¹Õż·“Ó¦ĖŁĀŹ¼ÓæģŌ¼3”Į105±¶£»
¢ŚYŌŚ600”ꏱ“߻Ɗ§ĀŹ×īøߣ¬ÄÜŹ¹Õż·“Ó¦ĖŁĀŹ¼ÓæģŌ¼3”Į105±¶£»
¢ŪZŌŚ440”ꏱ“߻Ɗ§ĀŹ×īøߣ¬ÄÜŹ¹Äę·“Ó¦ĖŁĀŹ¼ÓæģŌ¼1”Į106±¶£»
øł¾ŻÉĻŹöŠÅĻ¢£¬ÄćČĻĪŖŌŚÉś²śÖŠÓ¦øĆŃ”ŌńµÄŹŹŅĖ“߻ƼĮŹĒ £ØĢī”°X”±»ņ”°Y”±»ņ”°Z”±£©£¬Ń”ŌńµÄĄķÓÉŹĒ £»
£Ø3£©ĒėŌŚ“šĢāæØÖŠ£¬»³ö£Ø2£©ÖŠ·“Ó¦ŌŚÓŠ“߻ƼĮÓėĪŽ“߻ƼĮĮ½ÖÖĒéæöĻĀ·“Ó¦¹ż³ĢÖŠĢåĻµÄÜĮæ±ä»ÆŹ¾ŅāĶ¼£¬²¢½ųŠŠ±ŲŅŖ±ź×¢”£
£Ø4£©ŗĻ³ÉĘųŗĻ³É¼×“¼µÄÖ÷ŅŖ·“Ó¦ŹĒ£ŗ2H2(g)+CO(g) CH3OH(g) ”÷H=£90.8kJ”¤mol£1£¬T”ęĻĀ“Ė·“Ó¦µÄĘ½ŗā³£ŹżĪŖ160”£
CH3OH(g) ”÷H=£90.8kJ”¤mol£1£¬T”ęĻĀ“Ė·“Ó¦µÄĘ½ŗā³£ŹżĪŖ160”£
“ĖĪĀ¶ČĻĀ£¬ŌŚĆܱÕČŻĘ÷ÖŠæŖŹ¼Ö»¼ÓČėCO”¢H2£¬·“Ó¦10minŗó²āµĆø÷×é·ÖµÄÅضČČēĻĀ£ŗ
| ĪļÖŹ | H2 | CO | CH3OH |
| ÅضČ/£Ømol”¤L£1£© | 0.20 | 0.10 | 0.40 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
Ņ»¶ØĢõ¼žĻĀ£¬·“Ó¦2AB(g)  A2(g)£«B2(g)“ļµ½Ę½ŗāדĢ¬µÄ±źÖ¾ŹĒ
A2(g)£«B2(g)“ļµ½Ę½ŗāדĢ¬µÄ±źÖ¾ŹĒ
A£®µ„Ī»Ź±¼äÄŚÉś³Én molA2µÄĶ¬Ź±ĻūŗÄn molB2
B£®ČŻĘ÷ÄŚ£¬ AB”¢A2”¢B2ČżÖÖĘųĢå¹²“ę
C£®ABµÄĻūŗÄĖŁĀŹµČÓŚA2µÄĻūŗÄĖŁĀŹ
D£®ČŻĘ÷ÖŠø÷×é·ÖµÄĢå»ż·ÖŹż²»Ėꏱ¼ä±ä»Æ
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com