
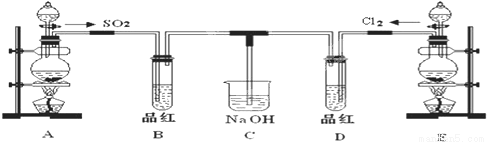
(13分)根据要求完成下列各小题实验目的。(a、b 为弹簧夹,加热及固定装置已略去)
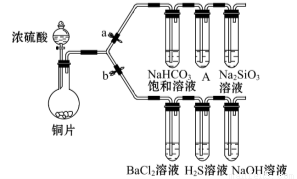
(1)验证碳、硅非金属性的相对强弱。(已知酸性:亚硫酸 >碳酸)
①连接仪器、 、加药品后,打开a关闭 b,然后滴入浓硫酸,加热。
②铜与浓硫酸反应的化学方程式是__________________,装置A中的试剂是 。
③能说明碳的非金属性比硅强的实验现象是:_______________________。
(2)验证 SO2的氧化性、还原性和酸性氧化物的通性。
①打开b,关闭a。能验证SO2具有氧化性的化学方程式是:___________。
②若大量的SO2通入NaOH溶液中,其化学方程式是:__________________。
③BaCl2溶液中无沉淀现象,将其分成两份,分別滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。
滴加的溶液 | 氯 水 | 氨 水 |
沉淀的化学式 |
|
|
写出其中SO2 显示还原性并生成沉淀的离子方程式___________________。
(13分) (1) ①检验装置的气密性(1分)
②Cu+2H2SO4(浓) 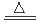 CuSO4+SO2↑+2H2O(1分)酸性KMnO4溶液(1分)
CuSO4+SO2↑+2H2O(1分)酸性KMnO4溶液(1分)
③A中酸性KMnO4溶液不褪色,Na2SiO3溶液中出现白色沉淀(2分)
(2) ①2H2S+SO2==3S↓+2H2O(2分)②SO2+NaOH ==NaHSO3(2分)
③(各1分)BaSO4 、BaSO3。Ba2++SO2+Cl2+2H2O==BaSO4↓+4H++2Cl-(2分)
【解析】
试题分析:①连接仪器、检验装置的气密性、加药品后,打开a关闭 b,然后滴入浓硫酸,加热。这时发生反应产生SO2气体。②铜与浓硫酸反应的化学方程式是Cu+2H2SO4(浓)  CuSO4+SO2↑+2H2O;由于SO2溶于水产生H2SO3,由于酸性H2SO3> H2CO3,所以在饱和NaHCO3溶液中发生反应,NaHCO3+ SO2= CO2+ NaHSO3,微粒证明C、Si的非金属性强弱,所以应该把混在产生CO2气体的SO2气体装置A中除去,该装置的试剂是酸性KMnO4溶液;若A中紫色变浅,证明SO2气体被除去干净,CO2气体通入到Na2SiO3,会发生反应:Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓,形成白色沉淀;故③能说明碳的非金属性比硅强的实验现象是:A中酸性KMnO4溶液不褪色(或变浅),Na2SiO3溶液中出现白色沉淀;(2) ①打开b,关闭a。能验证SO2具有氧化性的实验现象是H2S溶液中产生淡黄色沉淀,反应的化学方程式是2H2S+SO2=3S↓+2H2O;②若大量的SO2通入NaOH溶液中,会发生反应形成酸式盐,其化学方程式是SO2+NaOH =NaHSO3;③由于酸性HCl> H2SO3,所以向BaCl2溶液中通入SO2,只是产生少量的H2SO3,而无沉淀现象,当向其中加入氯水时,会发生反应:Cl2+SO2+2H2O=H2SO4+2HCl。H2SO4+BaCl2=BaSO4↓+2HCl,产生BaSO4白色沉淀;若向其中加入氨水,则会发生反应:SO2+2NH3·H2O=(NH4)2SO3+H2O, (NH4)2SO3+BaCl2=BaSO3↓+2NH4Cl,产生BaSO3白色沉淀。其中SO2 显示还原性并生成沉淀的离子方程式是Ba2++SO2+Cl2+2H2O==BaSO4↓+4H++2Cl-。
CuSO4+SO2↑+2H2O;由于SO2溶于水产生H2SO3,由于酸性H2SO3> H2CO3,所以在饱和NaHCO3溶液中发生反应,NaHCO3+ SO2= CO2+ NaHSO3,微粒证明C、Si的非金属性强弱,所以应该把混在产生CO2气体的SO2气体装置A中除去,该装置的试剂是酸性KMnO4溶液;若A中紫色变浅,证明SO2气体被除去干净,CO2气体通入到Na2SiO3,会发生反应:Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓,形成白色沉淀;故③能说明碳的非金属性比硅强的实验现象是:A中酸性KMnO4溶液不褪色(或变浅),Na2SiO3溶液中出现白色沉淀;(2) ①打开b,关闭a。能验证SO2具有氧化性的实验现象是H2S溶液中产生淡黄色沉淀,反应的化学方程式是2H2S+SO2=3S↓+2H2O;②若大量的SO2通入NaOH溶液中,会发生反应形成酸式盐,其化学方程式是SO2+NaOH =NaHSO3;③由于酸性HCl> H2SO3,所以向BaCl2溶液中通入SO2,只是产生少量的H2SO3,而无沉淀现象,当向其中加入氯水时,会发生反应:Cl2+SO2+2H2O=H2SO4+2HCl。H2SO4+BaCl2=BaSO4↓+2HCl,产生BaSO4白色沉淀;若向其中加入氨水,则会发生反应:SO2+2NH3·H2O=(NH4)2SO3+H2O, (NH4)2SO3+BaCl2=BaSO3↓+2NH4Cl,产生BaSO3白色沉淀。其中SO2 显示还原性并生成沉淀的离子方程式是Ba2++SO2+Cl2+2H2O==BaSO4↓+4H++2Cl-。
考点:考查碳、硅非金属性的相对强弱的比较及SO2的氧化性、还原性、酸性的检验方法的知识。


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源:2015届浙江省温州市十校联合体高三上学期期中联考化学试卷(解析版) 题型:选择题
海洋中有丰富的食品、矿产,能源、药物和水产资源等(如下图所示),
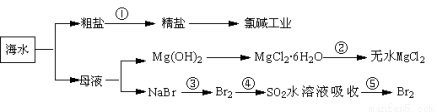
下列有关说法正确的是( )
A.第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:
Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
B.第②步中结晶出的MgCl2·6H2O可在空气中受热分解制无水MgCl2
C.在第③④⑤步中溴元素均被氧化
D.从第③步到第⑤步的目的是为了浓缩
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三月考(10月)化学试卷(解析版) 题型:填空题
(12分)(1)请在下图所示元素周期表中用实线画出主族元素的边界。
(2)元素甲是第三周期ⅦA族元素,甲元素与另两种非金属元素可组成离子化合物A。写出A的电子式________。
(3)在所有的气态氢化物中,元素乙的氢化物最稳定,写出元素乙的单质与水反应的化学方程式 。
(4)金属元素丙与两种非金属元素形成的化合物溶液常用于检验CO2,则元素丙的简单离子与元素甲的简单离子的半径大小关系是 (用离子符号表示),元素丁的原子序数比丙小8,写出元素丁的单质在CO2中燃烧的化学方程式 。
(5)元素戊是第三周期中简单离子半径最小的元素,写出该元素的最高价氧化物对应水化物的电离方程式 。
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三月考(10月)化学试卷(解析版) 题型:选择题
燃料电池能有效提高能源利用率,具有广泛的应用前景。下列物质均可用作燃料电池的燃料,其中最环保的是
A.甲醇 B.天然气 C.液化石油气 D.氢气
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三月考(10月)化学试卷(解析版) 题型:选择题
“嫦娥一号”卫星完成四大科学目标之一是探测下列14种元素的含量和分布:K、Th(钍)、U(铀)、O、Si、Mg、Al、Ca、Fe、Ti(钛)、Na、Mn、Cr(铬)、Gd(钆),其原子的最外层电子数是奇数的主族元素有
A.2种 B.3种 C.4种 D.5种
查看答案和解析>>
科目:高中化学 来源:2015届浙江省杭州市高三10月月考化学试卷(解析版) 题型:选择题
甲、乙两烧瓶中各盛有100mL3mol·L-1的盐酸和氢氧化钾溶液;向两烧瓶中分别加入等质量的铝粉,反应结束测得生成的气体体积甲∶乙=2∶3(相同状况),则加入铝粉的质量为
A.2.7g B.3.6g C.5.04g D.4.05g
查看答案和解析>>
科目:高中化学 来源:2015届浙江省杭州市高三10月月考化学试卷(解析版) 题型:选择题
锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水。当生成1 mol硝酸锌时,被还原的硝酸的物质的量为
A.2 mol B.1 mol C.0.5 mol D.0.25 mol
查看答案和解析>>
科目:高中化学 来源:2015届浙江省慈溪市、余姚市高三上学期期中联考化学试卷(解析版) 题型:实验题
(10分)某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
(1)实验室用装置A制备SO2.某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能: ;
(2)实验室用装置E制备Cl2,其反应的化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。若有0.6 mol的HCl参加反应,则转移的电子总数为 mol;
MnCl2+Cl2↑+2H2O。若有0.6 mol的HCl参加反应,则转移的电子总数为 mol;
(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:
B: ,D: ;
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象是:
B: ,D: ;
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强.他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样.请你分析该现象的原因(用化学方程式表示): 。如果用0.01 mol SO2与0.01 mol Cl2同时非常缓慢地通入100 mL水中,假如得到的溶液体积仍为100 mL,则所得溶液中氢离子的物质的量浓度约为 。
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期第二次质量检测化学试卷(解析版) 题型:选择题
由一种阳离子与两种酸根离子组成的盐称为混盐。混盐CaOC12在酸性条件下可以产生C12 ,下列关于混盐CaOC12的有关判断不正确的是
A.该混盐与硫酸反应产生1molC12时转移2NA个电子
B.该混盐的水溶液呈碱性
C.该混盐具有较强的氧化性
D.该混盐中氯元素的化合价为+1和-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com