
 (1)目前工业合成氨的原理是N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ•mol-1.
(1)目前工业合成氨的原理是N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ•mol-1.分析 (1)已知:①2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=+l530.0kJ•mol-1,
②N2(g)+3H2(g)=2NH3(g)△H=-93.0kJ•mol-1,
根据盖斯定律,(②×2-①)÷6可得:H2(g)+$\frac{1}{2}$O2(g)=H2O(l);
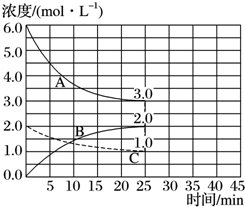
(2)①同一可逆反应中同一段时间内,各物质浓度变化量之比等于其计量数之比,达到平衡状态时△c(A)=(6.0-3.0)mol/L=3.0mol/L、△c(B)=(2.0-0)mol/L=2.0mol/L、△c(C)=(2.0-1.0)mol/L=1.0mol/L,根据图知,A、C是反应物、B是生成物,A、C、B的计量数之比=3.0mol/L:1.0mol/L:2.0mol/L=3:1:2,所以A表示氢气的反应,v(H2)=$\frac{△c}{△t}$;
②化学平衡常数K=$\frac{{c}^{2}(N{H}_{3})}{{c}^{3}({H}_{2}).c({N}_{2})}$;
③设反应容器体积为xL,则生成的n(NH3)=xmol,
N2(g)+3H2(g)=2NH3(g)
1mol 3mol 0
0.5xmol 1.5xmol xmol
(1-0.5x)mol (3-1.5x)mol xmol
恒温恒压下,气体的体积之比等于其物质的量之比,
所以$\frac{4mol}{4mol-xmol}$=$\frac{2L}{xL}$
x=$\frac{4}{3}$
则平衡时c(NH3)=1mol/L、c(N2)=$\frac{1-\frac{1}{2}×\frac{4}{3}}{\frac{4}{3}}$mol/L=0.25mol/L,c(H2)=$\frac{3-1.5×\frac{4}{3}}{\frac{4}{3}}$mol/L=0.75mol/L,
化学平衡常数=$\frac{{1}^{2}}{0.25×0.7{5}^{3}}$=9.5
根据这两种温度下的平衡常数相对大小判断温度相对大小;
(3)A.恒温恒压下,气体体积之比等于其物质的量之比,当气体体积不再变化时,各气体的物质的量不再变化,根据M=$\frac{m}{n}$判断;
B.恒温恒压下,气体密度与摩尔质量成正比,当气体密度不再变化,该反应达到平衡状态;
C.平衡后,往装置中通入一定量Ar,总压强不变,但参加反应的气体分压减小;
D.平衡后,压缩容器,气体压强增大,平衡正向移动;
(4)常温下,测得某纯CaSO3与水形成的浊液pH为9,由可知CaSO3(s)?Ca2+(aq)+SO32-(aq),且SO32-+H2O?HSO3-+OH-,由Ka2(H2SO3)=6.0×10-9可知SO32-+H2O?HSO3-+OH-的水解Kh=$\frac{1{0}^{-14}}{6×1{0}^{-9}}$=1.67×10-4,以此计算c(SO32-),溶液中c(Ca2+)=c(SO32-)+c(HSO3-),结合Ksp(CaSO3)=c(Ca2+)×c(SO32-)计算;
(5)根据电池反应式知,负极上氨气失电子发生氧化反应.
解答 解:(1)已知:①2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=+l530.0kJ•mol-1,
②N2(g)+3H2(g)=2NH3(g)△H=-93.0kJ•mol-1,
根据盖斯定律,(②×2-①)÷6可得:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-286kJ/mol
故答案为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-286kJ/mol;
(2)①同一可逆反应中同一段时间内,各物质浓度变化量之比等于其计量数之比,达到平衡状态时△c(A)=(6.0-3.0)mol/L=3.0mol/L、△c(B)=(2.0-0)mol/L=2.0mol/L、△c(C)=(2.0-1.0)mol/L=1.0mol/L,根据图知,A、C是反应物、B是生成物,A、C、B的计量数之比=3.0mol/L:1.0mol/L:2.0mol/L=3:1:2,所以A表示氢气的反应,v(H2)=$\frac{△c}{△t}$=$\frac{3.0mol/L}{25min}$=0.12mol/(L.min),
故答案为:0.12;
②化学平衡常数K=$\frac{{c}^{2}(N{H}_{3})}{{c}^{3}({H}_{2}).c({N}_{2})}$=$\frac{2.{0}^{2}}{3.{0}^{3}×1.0}$=0.15,
故答案为:0.15;
③设反应容器体积为xL,则生成的n(NH3)=xmol,
N2(g)+3H2(g)=2NH3(g)
1mol 3mol 0
0.5xmol 1.5xmol xmol
(1-0.5x)mol (3-1.5x)mol xmol
恒温恒压下,气体的体积之比等于其物质的量之比,
所以$\frac{4mol}{4mol-xmol}$=$\frac{2L}{xL}$
x=$\frac{4}{3}$
则平衡时c(NH3)=1mol/L、c(N2)=$\frac{1-\frac{1}{2}×\frac{4}{3}}{\frac{4}{3}}$mol/L=0.25mol/L,c(H2)=$\frac{3-1.5×\frac{4}{3}}{\frac{4}{3}}$mol/L=0.75mol/L,
化学平衡常数=$\frac{{1}^{2}}{0.25×0.7{5}^{3}}$=9.5>0.15,
该反应的正反应是放热反应,降低温度平衡常数增大,所以T2<T1,
故答案为:<;
(3)A.恒温恒压下,气体体积之比等于其物质的量之比,当气体体积不再变化时,各气体的物质的量不再变化,根据M=$\frac{m}{n}$知,混合气体质量始终不变,当物质的量不变时其平均摩尔质量不变,故正确;
B.恒温恒压下,气体密度与摩尔质量成正比,当气体密度不再变化,该反应达到平衡状态,则正逆反应速率相等,故错误;
C.平衡后,往装置中通入一定量Ar,总压强不变,但参加反应的气体分压减小,平衡逆向移动,故错误;
D.平衡后,压缩容器,气体压强增大,平衡正向移动,但参加反应的气体物质的量浓度小于气体增加的物质的量浓度,所以氮气浓度增大,故正确;
故选AD;
(4)由Ka2(H2SO3)=6.0×10-9可知SO32-+H2O?HSO3-+OH-的水解Kh=$\frac{1{0}^{-14}}{6×1{0}^{-9}}$=1.67×10-4,常温下,测得某纯CaSO3与水形成的浊液pH为9,c(HSO3-)=c(OH-)=1×10-5,
可知c(SO32-)=$\frac{(1×1{0}^{-5})^{2}}{1.67×1{0}^{-4}}$=6×10-5,
又c(Ca2+)=c(SO32-)+c(HSO3-)=7×10-5,
Ksp(CaSO3)=c(Ca2+)×c(SO32-)=7×10-5×6×10-5=4.2×10-9,
故答案为:4.2×10-9;
(5)原电池负极失去电子发生氧化反应,所以该燃料电池中负极氨气失去电子生成氮气,电极反应式为2NH3+6OH--6e-=N2+6H2O,
故答案为:2NH3+6OH--6e-=N2+6H2O.
点评 本题考查较综合,涉及化学平衡计算、原电池原理、溶度积计算、盖斯定律等知识点,侧重考查学生分析计算能力,平衡常数及溶度积有关计算是难点,解答时要明确各个物理量的关系,书写电极反应式要结合电解质溶液酸碱性书写,题目难度较大.


 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
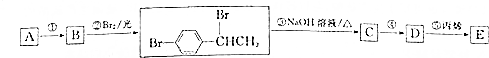
 或
或 .
. +Br2$\stackrel{铁}{→}$
+Br2$\stackrel{铁}{→}$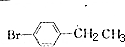 +HBr.反应③的化学方程式
+HBr.反应③的化学方程式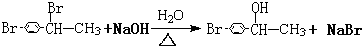 .
.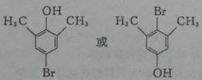 (任写一种).
(任写一种).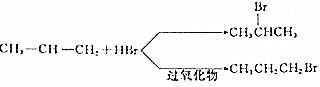
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
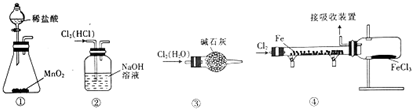
| A. | 用装置①制取氯气 | B. | 用装置②除去Cl2中的HCl | ||
| C. | 用装置③干燥氯气 | D. | 用装置④制取并收集FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
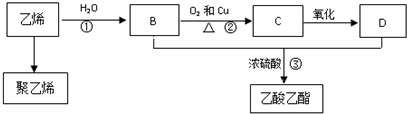
 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
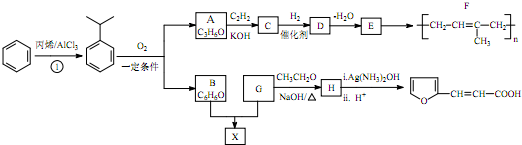
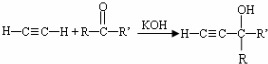
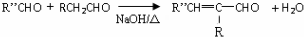 (-R、-R′、-R″表示可能相同或可能不同的原子或原子团)
(-R、-R′、-R″表示可能相同或可能不同的原子或原子团)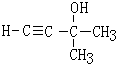 .
.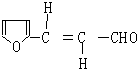 ,H的同分异构体中属于芳香族化合物的共有5种.
,H的同分异构体中属于芳香族化合物的共有5种.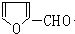 +CH3CHO$→_{△}^{NaOH}$
+CH3CHO$→_{△}^{NaOH}$ +H2O.
+H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由D和18O所组成的水11g,所含中子数为4NA | |
| B. | 1 L 0.4 mol•L-1稀硝酸与Fe完全反应,转移电子数为0.3NA | |
| C. | 标准状况下,2.24LCHCl3所含分子数为0.1NA | |
| D. | 密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
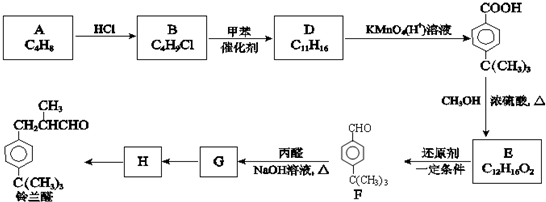
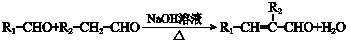
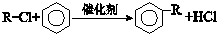
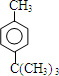 .
.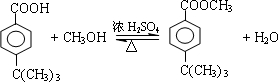 .
.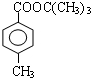 、
、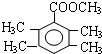 .(写出两种即可)
.(写出两种即可)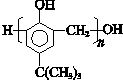 ,合成路线是
,合成路线是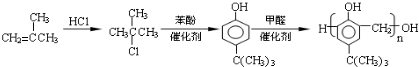 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 均含离子键 | B. | 都含离子键和共价键 | ||
| C. | 均含共价键 | D. | 均可与H2形成离子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com