
| A. | 肯定不含 I- | B. | 肯定不含 SO42- | C. | 可能含有 SO32- | D. | 肯定含有 NH4+ |
分析 向该无色溶液中滴加少量溴水,溶液仍呈无色,则一定不含Fe2+,一定含SO32-,结合离子浓度相等、溶液为电中性来解答.
解答 解:Fe2+、I-均与溴水发生氧化还原反应后,溶液具有颜色,由SO32-+I2+H2O═SO42-+2I-+2H+可知,
则向该无色溶液中滴加少量溴水,溶液仍呈无色,则一定不含Fe2+,一定含SO32-,
又离子浓度相等、溶液为电中性,
若阴离子只有SO32-,则含 Na+、NH4+、K+中的两种,
若含SO32-、I-,则含 Na+、NH4+、K+,
若含SO32-、SO42-,不遵循电荷守恒,则一定不存在SO42-,
故选B.
点评 本题考查常见离子的检验,为高频考点,把握氧化的先后顺序、发生的氧化还原反应为解答的关键,侧重分析与实验能力的考查,注意电荷守恒的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | a<b<0 | B. | b>d>0 | C. | 2a=b<0 | D. | 2c=d>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
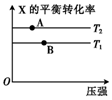 向某密闭容器中充入1mol X与2mol Y发生反应:X(g)+2Y(g)?aZ(g)△H<0,达到平衡后,改变某一条件(温度或容器体积),X的平衡转化率的变化如图所示.下列说法中正确的是( )
向某密闭容器中充入1mol X与2mol Y发生反应:X(g)+2Y(g)?aZ(g)△H<0,达到平衡后,改变某一条件(温度或容器体积),X的平衡转化率的变化如图所示.下列说法中正确的是( )| A. | a=2 | B. | T2>T1 | ||
| C. | A点的反应速率:3v正(X)=v逆(Z) | D. | 表示A、B两点的反应速率:v(A)>v(B) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
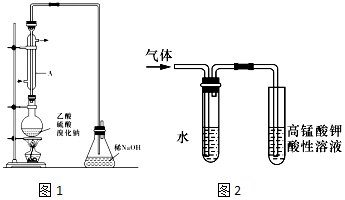
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
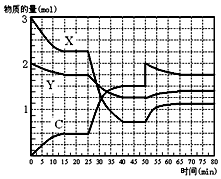 如图表示在一定条件下的1L的密闭容器中,X、Y、C三种气体因发生反应,三种气体的物质的量随时间的变化情况.下表是3mol X和1mol Y在一定温度和一定压强下反应,达到平衡时C的体积分数(C%).
如图表示在一定条件下的1L的密闭容器中,X、Y、C三种气体因发生反应,三种气体的物质的量随时间的变化情况.下表是3mol X和1mol Y在一定温度和一定压强下反应,达到平衡时C的体积分数(C%).| 压强/Mpa C% 温度/℃ | 0.1 | 10 | 20 |
| 200 | 15.3 | 81.5 | 86.4 |
| 300 | 2.2 | a | 64.5 |
| 400 | 0.4 | 25.1 | 38.2 |
| 500 | 0.1 | 10.6 | 19.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,水玻璃可用作木材防火剂,其主要成分是(写化学式)Na2SiO3.写出工业生产粗硅的化学方程式SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.高温条件下,二氧化硅、碳粉、氮气以物质的量之比3:6:2反应可以生成氮化硅陶瓷(一种新型无机非金属材料,具有耐高温、耐磨、抗氧化等特性)和另一种气体化合物,该反应的化学方程式为3SiO2+2N2+6C $\frac{\underline{\;高温\;}}{\;}$Si3N4+6CO.
,水玻璃可用作木材防火剂,其主要成分是(写化学式)Na2SiO3.写出工业生产粗硅的化学方程式SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.高温条件下,二氧化硅、碳粉、氮气以物质的量之比3:6:2反应可以生成氮化硅陶瓷(一种新型无机非金属材料,具有耐高温、耐磨、抗氧化等特性)和另一种气体化合物,该反应的化学方程式为3SiO2+2N2+6C $\frac{\underline{\;高温\;}}{\;}$Si3N4+6CO.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉、氨水和冰醋酸都属于混合物 | |
| B. | Fe(OH)3胶体无色、透明,能产生丁达尔现象 | |
| C. | 淀粉、纤维素、天然橡胶都是天然高分子化合物 | |
| D. | SiO2既能和NaOH溶液反应又能和氢氟酸反应,所有是两性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “天宫二号”使用的碳纤维,是一种新型有机高分子材料 | |
| B. | 施肥时,草木灰不能与铵盐混合使用,是因为它们之间发生反应会降低肥效 | |
| C. | 明矾常用作净水剂,是因为它能够消毒杀菌 | |
| D. | 14C可用于文物年代的鉴定,14C与12C互为同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com