
| A. | $\frac{{{ρ_1}+{ρ_2}}}{2}$ | B. | $\frac{30.0%+20.0%}{2}$ | C. | 小于25.0% | D. | 大于25.0% |
分析 氨水浓度越大密度越小.等体积相混合时,浓度较稀的氨水质量较大,而较浓的氨水的质量较小,根据公式溶质质量分数=$\frac{溶质质量}{溶液质量}$×100%计算.
解答 解:设30.0%的氨水和20.0%的氨水都是V,密度分别是ρ1、ρ2,氨水浓度越大密度越小,所以ρ1<ρ2<1,
则混合后的氨水的质量分数为:$\frac{30.0%×{ρ}_{1}V+20.0%×{ρ}_{2}V}{{ρ}_{1}V+{ρ}_{2}V}$=$\frac{30.0%{ρ}_{1}+20.0%{ρ}_{2}}{{ρ}_{1}+{ρ}_{2}}$=20.0%+$\frac{10.0%{ρ}_{1}}{{ρ}_{1}+{ρ}_{2}}$=20.0%+10%×$\frac{1}{1+\frac{ρ2}{{ρ}_{1}}}$,
由于ρ1<ρ2,则$\frac{{ρ}_{2}}{{ρ}_{1}}$>1,故1+$\frac{{ρ}_{2}}{{ρ}_{1}}$>2,20.0%+10%×$\frac{1}{1+\frac{ρ2}{{ρ}_{1}}}$<20.0%+10.0%×$\frac{1}{2}$=25.0%,
故选C.
点评 本题考查了有关溶质质量分数的简单计算,题目难度不大,明确氨水浓度与密度的关系为解答关键,注意掌握溶质质量分数的概念及表达式,试题侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:填空题
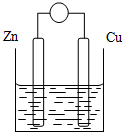 原电池是将化学能转变成电能的装置.原电池结构示意图(以Zn-Cu-稀H2SO4原电池为例)铜片和锌片作电极,稀硫酸做电解质溶液.
原电池是将化学能转变成电能的装置.原电池结构示意图(以Zn-Cu-稀H2SO4原电池为例)铜片和锌片作电极,稀硫酸做电解质溶液.| 电极 | 电极材料 | 电极反应式 | 反应类型 |
| 正极 | |||
| 负极 | |||
| 总反应式 | |||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 固体氯化铵和消石灰混合加热:NH4++OH- $\frac{\underline{\;\;△\;\;}}{\;}$ NH3↑+H2O | |
| B. | 硫化亚铁与盐酸反应:S2-+2H+═H2S↑ | |
| C. | 铜与稀硝酸:Cu+4H++2NO3-═Cu2++NO2↑+2H2O | |
| D. | 向氨水中通入过量的二氧化碳:NH3•H2O+CO2═NH4++HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可 | |
| B. | 热的浓盐酸可以除去试管内残留的MnO2 | |
| C. | 在未知溶液中滴加BaCl2溶液出现白色沉淀,加稀硝酸,沉淀不溶解,说明该未知溶液中存在SO42-或SO32- | |
| D. | 施肥时,草木灰(有效成分为K2CO3)与NH4Cl混合使用,可以同时提供K、N两种有效成分 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
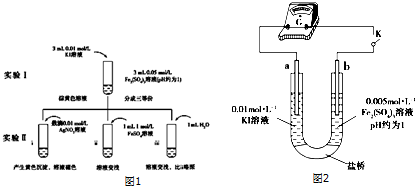
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
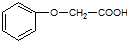 发生酯化反应的产物.
发生酯化反应的产物. 、
、 等.
等.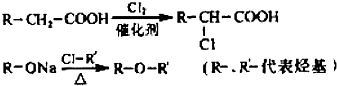
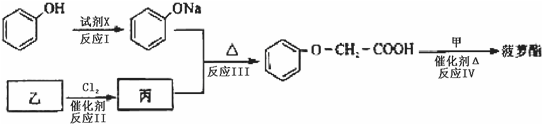
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com