
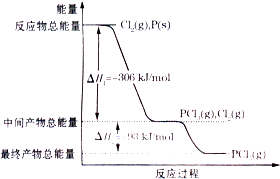
 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).下列说法正确的是( )
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).下列说法正确的是( )| A、P(s)和Cl2(g)一步直接生成1 mol PCl5(g) 的△H小于△H1+△H2 |
| B、PCl5(g)?PCl3(g)+Cl2(g)加入催化剂,达平衡时PCl5的分解率减小 |
| C、生成PCl3(g)的热化学方程式为2P(s)+3Cl2(g)=2PCl3(g)△H=-306 KJ/mol |
| D、工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,降温后,再和Cl2反应生成PCl5,这样有助于提高产率 |
| 3 |
| 2 |
| 3 |
| 2 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、Na2O2具有漂白性 |
| B、均与水反应生成NaOH,因而均是碱性氧化物 |
| C、Na2O中氧-2价,Na2O2中氧-1价 |
| D、均可与H2O、CO2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、MnO4-、K+、NO3-、SO32- |
| B、Na+、CO32-、Cl-、Al3+、NO3- |
| C、Na+、S2-、OH-、K+、Cl-、NO3- |
| D、Fe2+、H+、Na+、Ca2+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
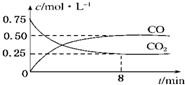 某温度下,在一密闭容器中充入一定量CO2,并加入足量铁粉,发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g),测得CO2和CO浓度随时间的变化如图所示:
某温度下,在一密闭容器中充入一定量CO2,并加入足量铁粉,发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g),测得CO2和CO浓度随时间的变化如图所示:| c(CO) |
| c(CO2) |
| 温度/K | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E、F六种短周期主族元素,其原子序数依次增大.A、D同主族;A与B、C均可形成多种常见的10电子微粒;在同一周期中,简单离子半径E的最小,原子半径F的最小;B的单质分子中有三对共用电子对.请回答下列问题:
A、B、C、D、E、F六种短周期主族元素,其原子序数依次增大.A、D同主族;A与B、C均可形成多种常见的10电子微粒;在同一周期中,简单离子半径E的最小,原子半径F的最小;B的单质分子中有三对共用电子对.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
A、H2(g)+Cl2(g)=2HCl(g);△H=-a
| ||||
B、C(s)+
| ||||
| C、2H2(g)+O2(g)=2H2O(l);△H=-a2H2(g)+O2(g)=2H2O(g);△H=-b | ||||
| D、S(g)+O2(g)=SO2 (g);△H=-aS(s)+O2(g)=SO2 (g);△H=-b |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、红棕色的NO2,加压后颜色先变深后变浅 |
| B、高压比常压有利于合成SO3的反应 |
| C、合成NH3在较高温度下进行 |
| D、黄绿色的氯水光照后颜色变浅 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com