
【题目】某固体单质1mol直接跟过量的氯气反应后,固体质量增加71g,则这种单质可能是
A.NaB.MgC.FeD.Al
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D 原子序数依次增加,X、Y、Z、W是由这四种元素中的两种元素组成的常见化合物,X为有刺激性气味的气体,Y为淡黄色固体,甲是由C元素形成的气体单质,乙为红棕色气体,上述物质之间的转化关系如下图所示(部分反应物或生成物省略)。下列说法正确的是

A. 原子半径大小顺序:D>C>B>A B. 最简单气态氢化物的稳定性:B>C
C. 图示转化关系涉及的反应均为氧化还原反应 D. 元素C、D形成的化合物中一定只含离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100g浓度为18mol/L的浓硫酸(密度为ρg/cm3)中加入一定量的水,稀释成9mol/L的硫酸,则加入水的体积为
A.小于100mLB.等于100mLC.大于100mLD.等于100/ρmL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于阿司匹林,下列说法正确的是( ) 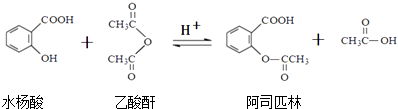
A.不能用FeCl3 溶液鉴别水杨酸和阿司匹林
B.服用阿司匹林出现水杨酸反应时,可静脉注射NaHCO3溶液
C.1 mol阿司匹林最多可消耗2 mol NaOH
D.该反应不属于取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于2mol二氧化碳的叙述中,正确的是( )
A. 质量为44g B. 含有4mol O C. 分子数为6.02×1023 D. 共有3mol原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化物在冶金等行业应用广泛,含氰废水的处理显得尤为重要.含氰废水中的氰化物常以[Fe(CN)6]3﹣和CN﹣的形式存在,工业上有多种废水处理方法. 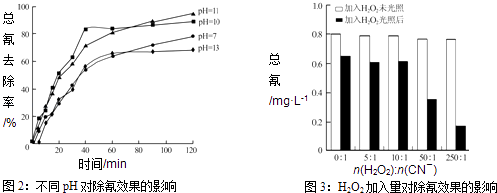
(1)电解处理法 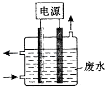
图1电源废水铁电极石墨电极
用图1所示装置处理含CN﹣废水时,控制溶液pH为9~10并加入NaCl,一定条件下电解,阳极产生的ClO﹣将CN﹣氧化为无害物质而除去.铁电极为(填“阴极”或“阳极”),阳极产生ClO﹣的电极反应为 .
(2)UV(紫外光线的简称)﹣H2O2氧化法. 实验过程:取一定量含氰废水,调节pH,加入一定物质的量的H2O2 , 置于UV工艺装置中,光照一定时间后取样分析.
【查阅资料】①在强碱性溶液中4[Fe(CN)6]3﹣+4OH﹣═4[Fe(CN)6]4﹣+O2↑+2H2O,[Fe(CN)6]4﹣更稳定;
②[Fe(CN)6]3﹣转化为CN﹣容易被H2O2除去;
③HCN是有毒的弱酸,易挥发.
Ⅰ.废水中的CN一经以下反应实现转化:CN一+H2O2+H2O═A+NH3↑,则A是(用符号表示).
Ⅱ.K3[Fe(CN)6]在中性溶液中有微弱水解,用方程式表示水解反应 .
Ⅲ.含氰废水在不同pH下的除氰效果如图2所示,pH选择的最佳范围应为(a.7﹣10;b.10﹣11;c.11﹣13),解释选择该pH范围的原因 .
Ⅳ.图3表示某pH时,加入不同量H2O2 , 处理30min后测定的样品含氰浓度.由图可知:n(H2O2):n(CN﹣)=250:1时,剩余总氰为0.16mgL﹣1 , 除氰率达80%,计算0﹣30min时间段反应速率v(CN﹣)=mgL﹣1min﹣1(结果保留两位有效数字).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钠是一种重要的化工原料,主要采用氨碱法生产。回答下列问题:
(1)碳酸钠俗称 , 可作为碱使用的原因是(用离子方程式表示)。
(2)已知:①2NaOH(s)+CO2(g) ![]() Na2CO3(s)+H2O(g) ΔH1=127.4 kJ·mol1 ②NaOH(s)+CO2(g)
Na2CO3(s)+H2O(g) ΔH1=127.4 kJ·mol1 ②NaOH(s)+CO2(g) ![]() NaHCO3(s) ΔH1=131.5 kJ·mol1
NaHCO3(s) ΔH1=131.5 kJ·mol1
反应2Na2CO3(s) ![]() Na2CO3(s)+ H2O(g) +CO2(g)的ΔH= kJ·mol1 , 该反应的平衡常数表达式K=。
Na2CO3(s)+ H2O(g) +CO2(g)的ΔH= kJ·mol1 , 该反应的平衡常数表达式K=。
(3)向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时溶液中 ![]() =。已知Ksp(BaCO3)=2.6×109 , Ksp(BaSO4)=1.1×1010。
=。已知Ksp(BaCO3)=2.6×109 , Ksp(BaSO4)=1.1×1010。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)Si(g)+4HCl(g);△H=+Q kJmol﹣1(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达平衡时,吸收热量为Q kJ
C.反应至4min时,若HCl浓度为0.24 mol/L,则H2的反应速率为0.03 mol/(Lmin)
D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100mL 1molL﹣1的NaOH溶液恰好反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com