
| A. | 此反应是氧化还原反应 | B. | R的分子式为C2H8N2 | ||
| C. | 在反应中N2O4做还原剂 | D. | 生成3mol N2时电子转移数为16mol |
分析 该反应中根据原子守恒知,R分子式为C2H8N2,该反应中N元素化合价由-3价、+4价变为0价,C元素化合价由-1价变为+4价,得电子的反应物是氧化剂,失电子的反应物是还原剂,再结合各个物理量之间的关系式计算.
解答 解:A.N元素在反应物中以化合态存在,反应生成氮气,N元素化合价变化,反应是氧化还原反应,故A正确;
B.根据反应中原子守恒知,R分子式为C2H8N2,故B正确;
C.该反应中N元素化合价由-3价、+4价变为0价,C元素化合价由-1价变为+4价,所以是氧化还原反应,N2O4是氧化剂,故C错误;
D.每生成1mol N2,该反应转移电子的物质的量=1mol×$\frac{2}{3}$×2×(4-0)=$\frac{16}{3}$mol,故D正确;
故选C.
点评 本题考查氧化还原反应,明确反应中元素化合价变化是解本题关键,侧重考查基本概念及计算,难点是D中计算,注意氮气既是氧化产物又是还原产物,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 1:4 | B. | 1:9 | C. | 1:8 | D. | 1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
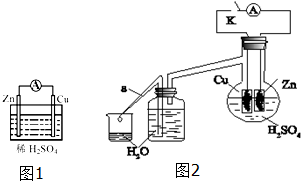 将锌片和铜片插入稀硫酸中构成如图1所示的装置,请回答下列问题:
将锌片和铜片插入稀硫酸中构成如图1所示的装置,请回答下列问题:| 1分钟水滴数(断开K) | 34 | 59 | 86 | 117 | … | 102 |
| 1分钟水滴数(闭合K) | 58 | 81 | 112 | 139 | … | 78 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量金属钠保存在煤油里 | |
| B. | 烧碱溶液盛装在使用玻璃塞的试剂瓶中 | |
| C. | 新制氯水通常保存在棕色试剂瓶中 | |
| D. | FeSO4溶液存放在加有少量铁粉的试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 符合的条件 | 物质的编号 |
| 混合物 | ②⑤⑧ |
| 电解质,但熔融状态并不导电 | ③ |
| 电解质,但难溶于水,也不与水反应 | ⑨ |
| 非电解质 | ④⑥⑫ |
| 既不是电解质,也不是非电解质,但本身能导电 | ①②⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某小组以工业氧化铁、草酸、盐酸、异丙醚为原料,合成晶体X[化学式为Fe2(C2O4)3•5H2O],并确定其纯度.
某小组以工业氧化铁、草酸、盐酸、异丙醚为原料,合成晶体X[化学式为Fe2(C2O4)3•5H2O],并确定其纯度.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com