
| A. | 通入过量Cl2:Fe2+、H+、NH4+、Cl-、SO42- | |
| B. | 加入少量NaClO溶液:NH4+、Fe2+、H+、SO42-、ClO- | |
| C. | 加入过量NaClO和NaOH的混合溶液:Na+、SO42-、Cl-、ClO-、OH- | |
| D. | 加入过量NaOH溶液:Na+、Fe2+、NH4+、SO42-、OH- |
 名校课堂系列答案
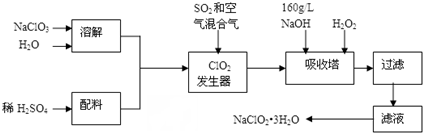
名校课堂系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③①④ | C. | ②①③④ | D. | ③②④① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在pH=1的溶液中:SO32-、Cl-、NO3-、Na+ | |
| B. | 在能使酚酞变红的溶液中:Na+、Cl-、NO3-、K+ | |
| C. | 在1 mol•L-1的NaAlO2溶液中:K+、Ba2+、SO42-、OH- | |
| D. | 在1 mol•L-1的AlCl3溶液中:NH4+、Ag+、Na+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2、SO2均能品红溶液褪色,说明二者漂白原理相同 | |
| B. | 浓Na2SO4溶液和甲醛都能使蛋白质从溶液中析出,说明二者均使蛋白质发生盐析 | |
| C. | CO2、SO2使澄清石灰水变浑浊,说明二者均为酸性氧化物 | |
| D. | 溶液中滴加硝酸酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下A、B两气体的密度之比为a:b | |
| B. | 同质量气体A与B的分子数之比为b:a | |
| C. | 两种气体A与B的相对分子质量之比为b:a | |
| D. | 相同状况下同体积A、B质量之比为a:b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8g | B. | 16g | C. | 24g | D. | 32g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com