
| A. | =2 | B. | >2 | C. | <2 | D. | 无法确定 |
科目:高中化学 来源: 题型:解答题
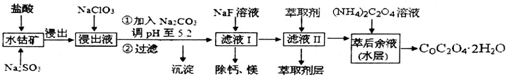
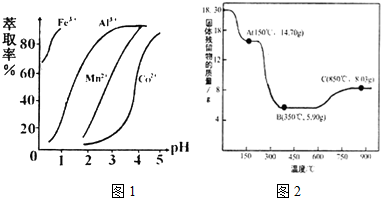
| 沉淀物 | Fe(OH)3 | Al(OH)3 | co(OH)2 | Fe(OH)2 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
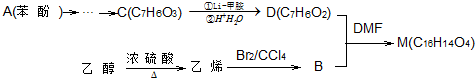
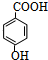

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①和②都是离子反应 | B. | 反应①和②都吸收热量 | ||
| C. | 反应①和②都放出热量 | D. | 反应③既不吸收热量也不放出热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 | B. | C2H6 | C. | C4H8 | D. | C3H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含大量Al3+的溶液中:K+、Na+、NO3-、CO32-不能大量共存,因有Al2(CO3)3沉淀生成 | |
| B. | 含大量Fe3+的溶液中:K+Mg2+、I-、Br2-不能大量共存,因2Fe3++2I-=2Fe2++I2 | |
| C. | 由水电离的c(H+)=1×10-14mol/L的溶液中:Ca2+、NO3-、HCO3-、Cl-不能大量共存,因溶液呈酸性,与HCO3-反应产生CO2气体 | |
| D. | 在NH4Fe(SO4)2溶液中:Na+、K+、S2-、SCN-不能大量共存,只是因Fe3+和S2-反应产生淡黄色的S沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
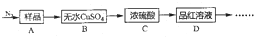
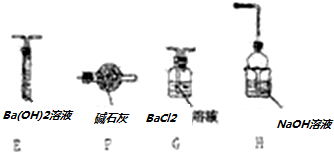
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 再加点溶质到容量瓶中去 | B. | 影响不大,不再处理 | ||
| C. | 用胶头滴管准确吸出标线上的溶液 | D. | 重新配制 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com