


 £¬·“Ó¦AµÄČČ»Æѧ·½³ĢŹ½ŹĒ4HCl£Øg£©+O2£Øg£©?2Cl2£Øg£©+2H2O£Øg£©”÷H=-115.6 KJ/mol£®
£¬·“Ó¦AµÄČČ»Æѧ·½³ĢŹ½ŹĒ4HCl£Øg£©+O2£Øg£©?2Cl2£Øg£©+2H2O£Øg£©”÷H=-115.6 KJ/mol£®·ÖĪö £Ø1£©ÓÉĶ¼Ź¾æÉÖŖ£¬Õūøö¹ż³ĢĪŖ£ŗ4HCl+O2=2Cl2+2H2O£¬·“Ó¦¢ŚÉś³É1molCl2£Øg£©µÄ·“Ó¦ČČĪŖ”÷H2£¬Ōņ·“Ó¦ČČ»Æѧ·½³ĢŹ½ĪŖ£ŗCuCl2£Øg£©+$\frac{1}{2}$O2£Øg£©=CuO£Øs£©+Cl2£Øg£©”÷H2£¬øł¾ŻøĒĖ¹¶ØĀɣآŁ+¢Ś£©”Į2æɵĆ×Ü·“Ó¦µÄČČ»Æѧ·½³ĢŹ½£»
£Ø2£©¢ŁĖ®ŹĒ¹²¼Ū»ÆŗĻĪļŅĄ¾Żµē×ÓŹ½ŹéŠ“·½·ØŠ“³öµē×ÓŹ½£»
¢Ś·“Ó¦AÖŠ£¬4mol HCl±»Ńõ»Æ£¬·Å³ö115.6kJµÄČČĮ棬ŅĄ¾ŻČČ»Æѧ·½³ĢŹ½ŹéŠ“·½·Ø£¬±ź×¢ĪļÖŹ¾Ū¼ÆדĢ¬ŗĶ¶ŌÓ¦ģŹ±äŠ“³ö£»
¢ŪŅĄ¾Ż·“Ó¦AÖŠ£¬4mol HCl±»Ńõ»Æ£¬·Å³ö115.6kJµÄČČĮ棬ģŹ±ä=·“Ó¦Īļ¶Ļ¼üĪüŹÕČČĮæ-Éś³ÉĪļŠĪ³É»Æѧ¼ü·Å³öČČĮæ¼ĘĖć£»
£Ø3£©ŅĄ¾ŻČČ»Æѧ·½³ĢŹ½ŗĶøĒĖ¹¶ØĀɼĘĖćĖłŠčČČ»Æѧ·½³ĢŹ½£¬¢Ł+¢Ü-¢Ś-¢Ū”Į$\frac{1}{2}$µĆµ½£»
½ā“š ½ā£ŗ£Ø1£©ÓÉĶ¼Ź¾æÉÖŖ£¬Õūøö¹ż³ĢĪŖ£ŗ4HCl+O2=2Cl2+2H2O£¬·“Ó¦¢ŁĪŖ£ŗ2HCl£Øg£©+CuO£Øs£©?H2O£Øg£©+CuCl2£Øs£©”÷H1£¬
·“Ó¦¢ŚÉś³É1molCl2£Øg£©µÄ·“Ó¦ČČĪŖ”÷H2£¬Ōņ·“Ó¦ČČ»Æѧ·½³ĢŹ½ĪŖ£ŗCuCl2£Øg£©+$\frac{1}{2}$O2£Øg£©=CuO£Øs£©+Cl2£Øg£©”÷H2£¬
øł¾ŻøĒĖ¹¶ØĀɣآŁ+¢Ś£©”Į2æɵĆ×Ü·“Ó¦µÄČČ»Æѧ·½³ĢŹ½£ŗ4HCl£Øg£©+O2£Øg£©=2Cl2£Øg£©+2H2O£Øg£©”÷H=2”÷H1+2”÷H2£¬
¹Ź“š°øĪŖ£ŗ2”÷H1+2”÷H2£»
£Ø2£©¢ŁĖ®ŹĒ¹²¼Ū»ÆŗĻĪļ£¬ŃõŌ×ÓŗĶĮ½øöĒāŌ×ÓŠĪ³ÉĮ½øö¹²¼Ū¼ü£¬µē×ÓŹ½ĪŖ£ŗ £¬
£¬
¹Ź“š°øĪŖ£ŗ £»
£»
¢ŚŅĄ¾Ż·“Ó¦AÖŠ£¬4mol HCl±»Ńõ»Æ£¬·Å³ö115.6kJµÄČČĮ棬·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ĪŖ£ŗ4HCl£Øg£©+O2£Øg£©?2Cl2£Øg£©+2H2O£Øg£©”÷H=-115.6 KJ/mol£»
¹Ź“š°øĪŖ£ŗ4HCl£Øg£©+O2£Øg£©?2Cl2£Øg£©+2H2O£Øg£©”÷H=-115.6 KJ/mol£»
¢ŪģŹ±ä=·“Ó¦Īļ¶Ļ¼üĪüŹÕČČĮæ-Éś³ÉĪļŠĪ³É»Æѧ¼ü·Å³öČČĮ棬4HCl£Øg£©+O2£Øg£©?2Cl2£Øg£©+2H2O£Øg£©”÷H=-115.6 KJ/mol£¬
4”ĮE£ØH-Cl£©+498-[243”Į2+4”ĮE£ØH-O£©]=-115.6£¬µĆµ½4”ĮE£ØH-O£©-4”ĮE£ØH-Cl£©=498-486+115.6=127.6
E£ØH-O£©-E£ØH-Cl£©=31.9”Ö32£¬H2OÖŠH-O¼ü±ČHClÖŠH-Cl¼üĒ棬
¹Ź“š°øĪŖ£ŗ32£»Ē森
£Ø3£©¢ŁH2£Øg£©+$\frac{1}{2}$O2£Øg£©ØTH2O£Øl£©”÷H1=-285.8kJ/mol
¢ŚH2£Øg£©ØTH2£Øl£©”÷H2=-0.92kJ/mol
¢ŪO2£Øg£©ØTO2£Øl£©”÷H3=-6.84kJ/mol
¢ÜH2O£Øl£©ØTH2O£Øg£©”÷H4=+44.0kJ/mol
ŅĄ¾ŻøĒĖ¹¶ØĀɼĘĖć¢Ł+¢Ü-¢Ś-¢Ū”Į$\frac{1}{2}$µĆµ½£¬·“Ó¦H2£Øl£©+$\frac{1}{2}$O2£Øl£©ØTH2O£Øg£©µÄ·“Ó¦ČČ”÷H=-285.8kJ/mol+£Ø+44.0kJ/mol£©-£Ø-0.92kJ/mol£©-£Ø-6.84kJ/mol
£©”Į$\frac{1}{2}$=-237.46KJ/mol£¬
¹Ź“š°øĪŖ£ŗ-237.46KJ/mol
µćĘĄ ±¾Ģāæ¼²éĮĖµē×ÓŹ½µÄŹéŠ“”¢ČČ»Æѧ·½³ĢŹ½ŹéŠ“£¬»Æѧ¼ü¼üÄÜŗĶģŹ±ä¹ŲĻµ¼ĘĖć£¬Ķ¼Ļó·ÖĪöÅŠ¶Ļ£¬ĢāÄæÄѶČÖŠµČ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | MgCl2 | B£® | KCl | C£® | MgSO4 | D£® | NaNO2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
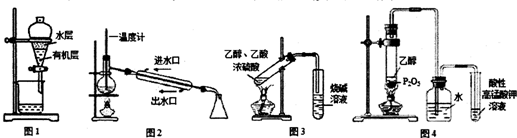
| A£® | ÓĆĶ¼1ĖłŹ¾×°ÖĆ·ÖĄėÓƱ½ŻĶČ”µāĖ®ŗóŅŃ·Ö²ćµÄÓŠ»ś²ćŗĶĖ®²ć | |
| B£® | ÓĆĶ¼2ĖłŹ¾×°ÖĆ½ųŠŠŹÆÓĶµÄ·ÖĮó | |
| C£® | ÓĆĶ¼3ĖłŹ¾×°ÖĆÖʱøÉŁĮæµÄŅŅĖįŅŅõ„ | |
| D£® | ÓĆĶ¼4ĖłŹ¾×°ÖĆÖĘČ”ŅŅĻ©²¢ŃéÖ¤ĘäŅ×±»Ńõ»Æ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā

| A£® | ĄūÓĆĶ¼1ĖłŹ¾×°ÖĆĪüŹÕÖĘȔɣĮ涞Ńõ»ÆĮņ²śÉśµÄĪ²Ęų | |
| B£® | ĄūÓĆĶ¼2ĖłŹ¾×°ÖĆÖĘČ”ŅŅĻ© | |
| C£® | ĄūÓĆĶ¼3ĖłŹ¾×°ÖĆÖ¤Ć÷H2CO3ĖįŠŌĒæÓŚ±½·Ó | |
| D£® | ĄūÓĆĶ¼4ĖłŹ¾×°ÖĆÖʱøŅŅĖįŅŅõ„ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĆŽ»Ø | B£® | ľ²Ä | C£® | Š”Āó | D£® | ŃņĆ« |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
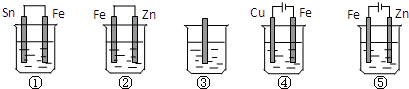
| A£® | ¢Ł£¾¢Ś£¾¢Ū£¾¢Ü£¾¢Ż | B£® | ¢Ż£¾¢Ł£¾¢Ū£¾¢Ś£¾¢Ü | C£® | ¢Ż£¾¢Ł£¾¢Ś£¾¢Ū£¾¢Ü | D£® | ¢Ż£¾¢Ś£¾¢Ł£¾¢Ū£¾¢Ü |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | KClO3ŌŚ·“Ó¦ÖŠµĆµ½µē×Ó£¬·¢ÉśŃõ»Æ·“Ó¦ | |
| B£® | ClO2ŹĒŃõ»Æ²śĪļ | |
| C£® | H2C2O4ÖŠ+3¼ŪµÄĢ¼ŌŖĖŲŌŚ·“Ó¦ÖŠ±»Ńõ»Æ | |
| D£® | 1mol KClO3²Ī¼Ó·“Ó¦ÓŠ2 molµē×Ó×ŖŅĘ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 2.4g½šŹōĆ¾Óė×ćĮæŃĪĖįĶźČ«·“Ó¦£¬Ź§µē×Ó×ÜŹżĪŖ0.2NA | |
| B£® | 2NAøö¶žŃõ»ÆĢ¼·Ö×ÓµÄÖŹĮæĪŖ44g | |
| C£® | 0.1mol/L NaClČÜŅŗÖŠ£¬Na+ÓėCl-Ąė×Ó×ÜŹżĪŖ0.1NA | |
| D£® | 17g°±ĘųÖŠĖłŗ¬Ō×ÓŹżĪŖNA |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com