工业上用CO生产燃料甲醇,发生反应:
CO(g)+2H
2(g)?CH
3OH(g);△H 图1表示反应过程中能量的变化情况;
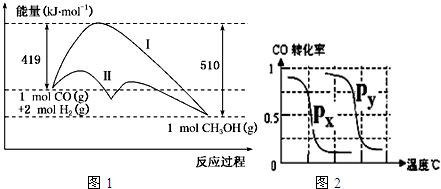
(1)在“图1”中,曲线
(填:Ⅰ或Ⅱ)表示使用了催化剂;该反应△H
0.(填“>”或“<”)
(2)一定条件下,在密闭容器中充入a mol CO与 3a mol H
2的混合气体在催化剂作用下发生反应.
①若容器容积不变,下列措施能使上述反应的反应速率增大,且平衡向正反应方向移动的是
.
A.升高温度
B.将CH
3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入1mol CO和3mol H
2E.选择高效催化剂
②为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件
已经填在下面实验设计表中
| 实验编号 | T(℃) | | P(MPa) |
| 1 | 150 | | 0.1 |
| 2 | a | | 5 |
| 3 | 350 | b | 5 |
A.则上表中剩余的实验条件数据:a=
、b=
.
B.根据反应Ⅱ的特点,图2是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强P
x=
MPa.
(3)已知:CH
3OH(g)+
O
2(g)=CO
2(g)+2H
2O(g)△H=-192.9kJ/molH
2O(l)=H
2O(g)△H=+44 kJ/mol,请写出表示CH
3OH(g)燃烧热的热化学方程式
.




 优生乐园系列答案
优生乐园系列答案