
下列叙述错误的是
A.生铁中含有碳,抗腐蚀能力比纯铁弱
B.用锡焊接的铁质器件,焊接处易生锈
C.铁管上镶嵌锌块,铁管不易被腐蚀
D.在铁制品上镀铜时,镀件为阳极,铜盐为电镀液
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
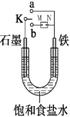
(Ⅰ)如图所示:
(1)若开始时开关K与a连接,则铁发生电化学腐蚀中的________腐蚀。
请写出正极反应式 。
(2)若开始时开关K与b连接时,两极均有气体产生,
则N端是电源的 极(填正或负)则总反应的离子方程式为 。
 |
(Ⅱ)用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾。
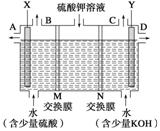
(1)X极与电源的_____(填“正”或“负”)极相连,氢气从_____(填“A、B、C或D”)口导出。
(2)已知离子交换膜只允许一类离子通过,则M为________(填“阴离子”或“阳离子”)交换膜。
(3)若制得标准状况下5.6 L氧气,则生成氢氧化钾的质量是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验原理或操作正确的是

A.用图1装置验证在该条件下铁钉发生吸氧腐蚀
B.用湿润的蓝色石蕊试纸检验氨气
C.用20mL量筒量取15mL酒精,加水5mL,配制质量分数为75%酒精溶液
D.用图2装置检验实验室制得的乙烯中混有SO2和CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.分散系中分散质粒子的直径:Fe(OH)3悬浊液> Fe(OH)3胶体> FeCl3溶液
B.能自发进行的化学反应,一定是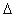 H<0、
H<0、 S>0
S>0
C.焰色反应是物质燃烧时火焰呈现的颜色变化,属于化学变化
D.钢铁发生电化学腐蚀时,负极的电极反应式为Fe-3e-= Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成。请回答下列问题:
(1)工业上采用电解氧化铝—冰晶石(Na3AlF6)熔融体的方法冶炼得到金属铝:2Al2O3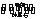 4Al+3O2↑
4Al+3O2↑
加人冰晶石的作用是_____________________。
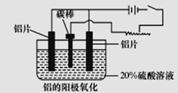
(2)上述工艺所得铝材中往往含有少最Fe和Si等杂质,可用电解方法进一步提纯,该电解池中阳极的电极反应式为_____________,下列可作阴极材料的是____________(填字母序号)。
A.铝材 B.石墨 C.铅板 D.纯铝
(3)阳极氧化能使金属表面生成致密的氧化膜。以稀硫酸为电解液,铝阳极发生的电极反应式为__________。
(4)在铝阳极氧化过程中,需要不断地调整电压,理由是______________________________。
(5)下列说法正确的是(填字母序号)。
A.阳极氧化是应用原电池原理进行金属材料表面处理的技术
B.铝的阳极氧化可增强铝表面的绝缘性能
C.铝的阳极氧化可提高金属铝及其合金的耐腐蚀性,但耐磨性下降
D.铝的阳极氧化膜富有多孔性,有很强的吸附性能,能吸附染料而呈各种颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,反应后固体物质增重的是( )
A.氨气通过灼热的CuO粉末 B. 将锌粒投入Cu(NO3)2溶液
C.铝与Fe2O3发生铝热反应 D.水蒸气通过Na2O2粉末
查看答案和解析>>
科目:高中化学 来源: 题型:
已知可逆反应:M(g)+N(g)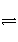
 P(g)+Q(g) ΔH>0,请回答下列问题:
P(g)+Q(g) ΔH>0,请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c0(M)=1 mol·L-1,c0(N)=2.4 mol·L-1;达到平衡后,M的转化率为60%,此时N的转化率为________;
(2)若反应温度升高,M的转化率________(填“增大”、“减小”或“不变”);
(3)若反应温度不变,反应物的起始浓度分别为:c0(M)=4 mol·L-1,c0(N)=a mol·L-1;达到平衡后,[P]=2 mol·L-1,a=________;
(4)若反应温度不变,反应物的起始浓度为:c0(M)=c0(N)=b mol·L-1,达到平衡后,M的转化率为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com