
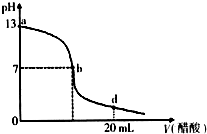
 向20mLNaOH溶液中逐滴加入0.2mol/L醋酸溶液,滴定曲线如图所示,下列说法不正确的是( )
向20mLNaOH溶液中逐滴加入0.2mol/L醋酸溶液,滴定曲线如图所示,下列说法不正确的是( )| A、该NaOH溶液的物质的量浓度为0.1 mol/L |
| B、在b点,c (Na+)=c(CH3COO-) |
| C、该NaOH溶液与醋酸溶液恰好完全反应的点位于曲线b、d间的某点 |
| D、在d点,溶液中所有离子浓度由大到小的顺序为c (CH3COO-)>c (Na+)>c (H+)>c (OH-) |


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
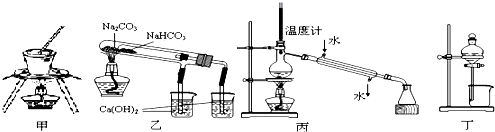
| A、用甲图装置可用于加热、灼烧固体 |
| B、用乙图装置验证NaHCO3和Na2CO3的热稳定性 |
| C、用丙图装置分离乙醇与水 |
| D、用丁图装置可由四氯化碳萃取碘水中的碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:
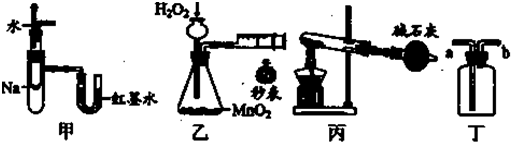
| A、装置甲可用于验证反应的热效应 |
| B、装置乙可定量测定化学反应的速率 |
| C、装置丙可用于实验室以NH4Cl为原料制备少量NH3 |
| D、装置丁a口进气可收集NH3、C12等气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(N2)﹕c(H2)﹕c(NH3)=1﹕3﹕2 |
| B、N2,H2和NH3的质量分数不再改变 |
| C、气体压强的压强不再改变 |
| D、单位时间内每增加1 mol N2,同时增加3 mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1,3-二甲基戊烷 |
| B、2-甲基-3,3-二乙基丁烷 |
| C、3,4-二甲基戊烷 |
| D、2,3-二甲基-3-乙基戊烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③④ | B、①③⑤ |
| C、①②③ | D、①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.15 mol?L-1 |
| B、0.2 mol?L-1 |
| C、0.3 mol?L-1 |
| D、0.4 mol?L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com