
【题目】能用H++OH﹣=H2O表示的化学方程式是( )
A.氢氧化钠溶液与醋酸反应
B.氢氧化铁与硫酸反应
C.氢氧化钡与硫酸反应
D.硫酸氢钠与氢氧化钠溶液反应
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案科目:高中化学 来源: 题型:
【题目】I.某次采集酸雨样品,每隔一段时间测定一次pH,得到数据如下:
时间 | 开始 | 8小时 | 16小时 | 24小时 | 32小时 | 40小时 | 48小时 |
pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
(1)放置时,雨水样品酸性_______________(填“增强”、“减弱”或“不变”)。
酸性变化的原因_________________________________(用化学方程式表示)。
II.汽车尾气(含有烃类、CO、SO2与NO等物质)是城市空气的污染源。冶理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的转化。
(2) 写出一氧化碳与一氧化氮反应的化学方程式:__________________________。
(3) 在“催化转化器”转化后的气体中有CO2、SO2,下列不能鉴别这两种气体的是(____)
A.KMnO4溶液 B.石灰水 C.BaCl2溶液 D.品红溶液
(4) 有效减少城市污染的方法可以有____________
A. 开发氢能源 B. 使用电动车 C. 植树造林 D. 戴上呼吸面具
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证氧化性Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验)。
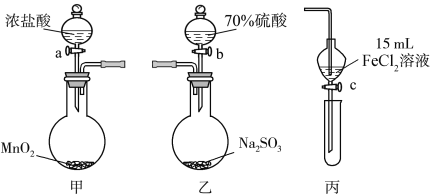
实验步骤:
1.在甲装置中,打开活塞a,加热,待装置中充满黄绿色气体时,与丙装置连接。
2.当丙装置中FeCl2溶液变黄时,停止加热。
3.打开活塞c,使约2 mL的溶液滴入试管中,检验溶液中的离子。
4.在乙装置中,打开活塞b,待空气排尽后,将乙中产生的气体通入上述丙装置变黄后的溶液中,一段时间后,停止。
5.更新丙中试管,打开活塞c,使约2 mL的溶液滴入试管中,检验溶液中的离子。
回答下列问题:
(1)甲中发生反应的化学方程式为_____________________。
(2)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是______________。
(3)实验中,证明氧化性Fe3+>SO2的离子方程式为_________________________。
(4)有Ⅰ、Ⅱ、Ⅲ三组同学分别完成了上述实验,实验结果如下:
步骤3溶液中含有的离子 | 步骤5溶液中含有的离子 | |
Ⅰ | 既有Fe3+又有Fe2+ | 有SO |
Ⅱ | 有Fe3+无Fe2+ | 有SO |
Ⅲ | 有Fe3+无Fe2+ | 有Fe2+ |
上述实验结果一定能够证明氧化性Cl2>Fe3+>SO2的是________(填“Ⅰ”“Ⅱ”或“Ⅲ”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到实验目的的是( )
A.检验NH![]() 时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体
时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体
B.向做完蔗糖水解后的溶液中直接加入新制的Cu(OH)2并加热,以检验蔗糖是否水解
C.将混有HCl的CO2通入饱和Na2CO3溶液中除去HCl
D.将Al2(SO4)3溶液蒸干制备Al2(SO4)3固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三草酸合铁酸钾晶体K3[Fe(C2O4)3]·3H2O可用于摄影和蓝色印刷,它受热易分解,为了验证其气态产物,某同学设计了如下实验装置:
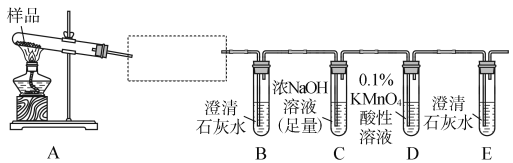
(1)若实验中,观察到B、E中的溶液均变浑浊,则D中的现象是_______________________;
说明其气态产物是________、________;为验证另一种气态产物,应在A、B之间增加的装置为________。
(2)为了使实验更安全、更严密,你认为该实验设计需要如何改进?
①______________________________;
②__________________________________。
(3)固体产物中铁元素不可能以+3价形式存在,理由是___________________________。
现设计实验,探究固体产物中铁元素的存在形式。
①提出合理假设。
假设1:_________________________________;
假设2:_________________________________;
假设3:_________________________________。
②某学生设计实验探究上述假设,除3%H2O2、蒸馏水外,还需要下列试剂中的____________________________。
限选试剂:浓硫酸、1.0 mol·L-1HNO3、1.0 mol·L-1盐酸、1.0 mol·L-1NaOH溶液、0.1 mol·L-1KI溶液、0.1 mol·L-1CuSO4溶液、20%KSCN溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体。
已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60 ℃时NaClO2分解成NaClO3和NaCl。Ba(ClO)2可溶于水。利用下图所示装置进行实验。
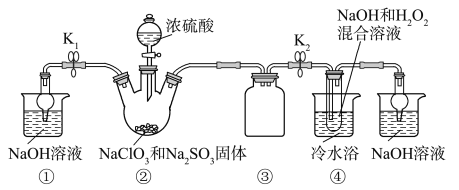
(1)装置①的作用是_______________,装置③的作用是______________________。
(2)装置②中产生ClO2气体的化学方程式为________________________。
(3)从装置④反应后的溶液获得晶体NaClO2的操作步骤为:
①减压,55 ℃蒸发结晶;
②趁热过滤;
③________________________;
④低于60 ℃干燥,得到成品。
实验Ⅱ:测定某亚氯酸钠样品的纯度。设计如下实验方案,并进行实验。
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO![]() +4I-+4H+===2H2O+2I2+Cl-)。将所得混合液配成100 mL待测溶液。
+4I-+4H+===2H2O+2I2+Cl-)。将所得混合液配成100 mL待测溶液。
②移取25.00 mL待测溶液于锥形瓶中,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为V mL(已知:I2 +2S2O![]() ===2I-+S4O
===2I-+S4O![]() )。
)。
(4)样品中NaClO2的质量分数为__________(用含m、c、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示。
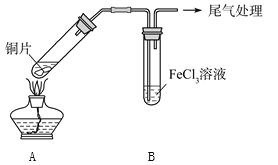
(1)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,然后开始实验。
步骤① | 配制1 mol·L-1FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管B中,加热A |
FeCl3溶液显酸性的原因是__________________。写出装置A中产生SO2的化学方程式:_______________________________。
(2)当SO2通入FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象。将混合液放置12小时,溶液才变成浅绿色。
【查阅资料】[Fe(HSO3)]2+为红棕色,它可以将Fe3+还原为Fe2+。生成
[Fe(HSO3)]2+的反应为可逆反应。
解释SO2与FeCl3溶液反应生成红棕色[Fe(HSO3)]2+的原因:_________________________。
写出溶液中[Fe(HSO3)]2+与Fe3+反应的离子方程式: ________________________。
(3)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了步骤②、③的实验。
步骤② | 往5 mL 1 mol·L-1FeCl3溶液中通入SO2气体,溶液立即变为红棕色。微热3 min,溶液颜色变为浅绿色 |
步骤③ | 往5 mL重新配制的1 mol·L-1FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色。几分钟后,发现溶液颜色变成浅绿色 |
用铁氰化钾溶液检验步骤②和步骤③所得溶液中的Fe2+,其现象为____________________。
(4)综合上述实验探究过程,可以获得的实验结论:
Ⅰ.SO2与FeCl3溶液反应生成红棕色中间产物[Fe(HSO3)]2+;
Ⅱ.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
Ⅲ.____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com