

分析 (1)①由图可知,10min到达平衡,平衡时甲醇的浓度变化为0.75mol/L,由方程式可知氢气的浓度变化等于甲醇的浓度变化量3倍为2.25mol/L结合v(H2)=$\frac{△c}{△t}$计算;
②根据图乙先拐先平衡,则温度Ⅱ>Ⅰ,再根据图象温度高CH3OH的产量少,说明升温平衡向逆反应方向移动,据此分析;
③化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量不发生变化;
④根据化学反应速率和化学平衡的影响因素进行判断;
(2)根据浓度商和化学平衡常数的相对大小判断,如果浓度商大于化学平衡常数,则反应向正反应方向移动,如果浓度商小于化学平衡常数,则反应向逆反应方向移动;
(3)该反应是气体体积不变的反应,压强不影响平衡,最终得到平衡时正逆反应速率与原平衡中的速率相等;但是恒压条件下加入再通入1mol H2和1mol CO2的混合气体后,容器的容积不大,反应物浓度增大,而生成物浓度减小,根据浓度对反应速率的影响画出正(v正)、逆(v逆)反应速率随时间t变化的示意图.
解答 解:(1)①由图可知,10min到达平衡,平衡时甲醇的浓度变化为0.75mol/L,由方程式CO2(g)+3H2(g)?CH3OH(g)+H2O可知,氢气的浓度变化等于甲醇的浓度变化量为0.75mol/L×3=2.25mol/L,故v(H2)=$\frac{2.25mol/L}{10min}$=0.225mol/(L•mon),故答案为:0.225;
③根据图乙先拐先平衡,则温度Ⅱ>Ⅰ,再根据图象温度高CH3OH的产量少,说明升温平衡向逆反应方向移动,则正反应是放热反应,温度高平衡常数小,曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ>KⅡ,故答案为:<;>;
③A.反应中CO2与CH3OH的物质的量浓度之比与反应起始时的物质的量和平衡时转化的程度有关,不能说明上述反应达到平衡状态,故A错误;
B.反应前后气体的计量数之和不相等,混合气体的压强不随时间的变化而变化,说明上述反应达到平衡状态,故B正确;
C.CO2的体积分数在混合气体中保持不变,则正逆反应速率相等,说明上述反应达到平衡状态,故C正确;
D.无论反应是否平衡,单位时间内每消耗3molH2,同时生成1molH2O,故D错误;
故答案为:BC;
④CO2(g)+3H2(g)?CH3OH(g)+H2O(g),反应是气体体积减小的放热反应,
A.将H2O(g)液化从体系中分离,减少生成物浓度,平衡正向进行,但反应速率减小,故A错误;
B.升高容器内温度,平衡逆向移动,故B错误;
C.恒温恒压充入He,相当于减小反应体系的压强,化学反应速率减小,平衡逆向移动,故C错误;
D.恒温恒容再充入1molCO2和3molH2,相当于增大压强,化学反应速率加快,平衡正向进行,故D正确;
故答案为:D;
(2)Qc=$\frac{0.20{\;}^{2}}{0.05}$=0.8<1.64,则平衡向正反应方向移动,故答案为:正;
(3)由于该反应是气体体积相等的反应,压强不影响平衡,所以最终得到平衡时的各组分含量、浓度与原平衡完全相同,所以达到平衡时的反应速率与原平衡时的速率相等;若再通入1mol H2和1mol CO2的混合气体后,由于恒压条件下,容器的容积增大,反应物浓度增大,生成物浓度减小,所以正反应速率增大,逆反应速率减小,之后正反应速率逐渐减小,逆反应速率增大,最终得到与原平衡相等的速率,据此画出的正(v正)、逆(v逆)反应速率随时间t变化的示意图为: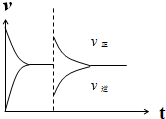 ,故答案为:
,故答案为: .
.
点评 本题涉及化学反应速率的计算、平衡图象的分析、化学平衡状态的判断、化学平衡常数的应用等知识点,注意分析化学方程式的特征以及温度对平衡移动的影响.


科目:高中化学 来源: 题型:选择题
| A. | 反应过程中得到6.72 L的气体(标况) | |
| B. | 最终得到的溶液中c(Na+)=c(Cl-)+c(OH-) | |
| C. | 最终得到7.8 g的沉淀 | |
| D. | 最终得到的溶液中c(NaCl)=2.0 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使石蕊溶液变红的溶液中:MnO4-、NO3-、SO42-、Na+、SO32- | |
| B. | 加入Al能放出H2的溶液中:Mg2+、NH4+、Cl-、Na+、SO42- | |
| C. | 使pH试纸变深蓝的溶液中:CO32-、NO3-、Na+、S2-、AlO2-、SO32- | |
| D. | pH=1的溶液中:Fe2+、Al3+、NO3-、I-、Cl-、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜时,同一时间内阳极溶解铜的质量比比阴极析出铜的质量小 | |
| B. | 高炉炼铁时,增加高炉高度,延长CO和铁矿石的接触时间,可以提高CO利用率 | |
| C. | 硫酸工业中,接触室内安装热交换器,是为了将SO2完全转化为SO3 | |
| D. | 侯氏制碱是将CO2和NH3先后通入饱和氯化钠溶液中得碳酸氢钠固体,再灼烧制碳酸钠固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键 | |
| B. | SiO2晶体中每个硅原子与两个氧原子以共价键相结合 | |
| C. | 金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低 | |
| D. | 晶体中分子间作用力越大,分子越稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a不可能显中性 | B. | a只能显碱性 | C. | b不可能显酸性 | D. | b只能显中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
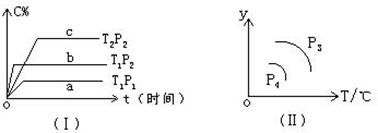
| A. | P3>P4,y轴表示A的转化率 | |
| B. | P3>P4,y轴表示B的质量分数 | |
| C. | P3>P4,y轴表示混合气体密度 | |
| D. | P3<P4,y轴表示混合气体的平均相对分子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
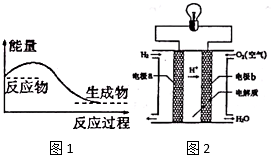 能盘是一个世界性的话题,如何充分利用能量、开发新能源,为人类服务是广大科技工作者不懈努力的目标.
能盘是一个世界性的话题,如何充分利用能量、开发新能源,为人类服务是广大科技工作者不懈努力的目标.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
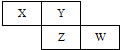 X、Y、Z、W四种短周期元素在周期表中的位置关系如图
X、Y、Z、W四种短周期元素在周期表中的位置关系如图 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com