
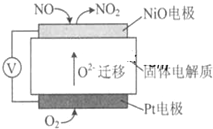
 SO2��NOx�Ǵ�������Ҫ��Ⱦ�
SO2��NOx�Ǵ�������Ҫ��Ⱦ�| 1 |
| 2 |
| 1 |
| 2 |
| (8��10-4)2 |
| (0.8-4��10-4)?(0.2-4��10-4) |
| ||
| ||


 ��ʦָ����ĩ��̾�ϵ�д�
��ʦָ����ĩ��̾�ϵ�д� �����ܿ����ϵ�д�
�����ܿ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����v����A���T2v����C��ʱ���ɶ϶���Ӧ�Ѵ�ƽ�� |
| B����ʼʱ�̺ʹ�ƽ��������е�ѹǿ��Ϊ 1��1 |
| C������A��B��ת����֮��Ϊ1��2 |
| D������ʼʱ����2molA��2amolB�����ƽ��ʱ����2bmolC |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��ͼ��ʵ��������ϩ�ķ���װ�ú���ϩ����ʵ��װ�ã���Ӧԭ��Ϊ��
��ͼ��ʵ��������ϩ�ķ���װ�ú���ϩ����ʵ��װ�ã���Ӧԭ��Ϊ��| Ũ���� |
| 170�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��xֵΪ2 |
| B�����������ܶ����� |
| C��ƽ��ʱN��Ũ��Ϊ0.3 mol/L |
| D��N��ת����Ϊ20% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ѡ�� | ʵ��Ŀ�� | ʵ�鷽�� |
| A | ����CH3CH2Br��NaOH��Һ���Ƿ���ˮ�� | ��CH3CH2Br��NaOH��Һ���ȣ���ȴ��ȡ���ϲ�ˮ��Һ������AgNO3��Һ���۲��Ƿ��������ɫ���� |
| B | ����Fe��NO3��2�����Ƿ����������� | ��Fe��NO3��2��Ʒ����ϡH2SO4�μ�KSCN��Һ���۲���Һ�Ƿ��� |
| C | ��֤�����ԣ�Fe3+��I2 | ��KI��FeCl3��Һ���Թ��л�Ϻ������ã��ɹ۲���Һ��ɫ�仯 |
| D | ��֤Fe��OH��3���ܽ��С��Mg��OH��2 | ��FeCl3��Һ����Mg��OH��2����Һ�У����ɹ۲쵽�����ɰ�ɫ��Ϊ���ɫ |
| A��A | B��B | C��C | D��D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��22.2% | B��30% |
| C��75.5% | D��80.6% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��c��NH4+����c��Cl-�� |
| B��c��H+��=c��OH-�� |
| C��c��NH4+��+c��NH3?H2O����c��Cl-�� |
| D��c��NH4+����c��Cl-��+c��OH-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���õι����Թ��еμ�Һ��ʱ���ιܼ�����Թ��ڱ� |
| B��������ƿע��Һ��ʱ����Һ�õIJ�����������ƿ���ڱ� |
| C��ʹ���Թܼ�ʱ��Ĵָ���ԹܼеĶ̱� |
| D��ʵ������ȡ��������ʱ�������ܵij������뱥��Na2CO3��Һ��Һ�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com