
【题目】设NA为阿伏加德罗常数的值。下列叙述正确的是
A. 17g H2O2中含有非极性键的数目为NA
B. 常温常压下,17g甲基(-14CH3)所含的中子数为9NA
C. 在含CO32-总数为NA的Na2CO3溶液中,Na+总数为2NA
D. 13. 8g NO2与足量水反应,转移的电子数为0.2NA
【答案】D
【解析】
A. H2O2的结构式为![]() ,17gH2O2物质的量为0.5mol,含有非极性键数目为0.5NA,A错误;
,17gH2O2物质的量为0.5mol,含有非极性键数目为0.5NA,A错误;
B.甲基(—14CH3)的质量数A为17,质子数Z =6+3×1= 9,故中子数N = A-Z = 8,17g甲基(—14CH3)物质的量为17g÷17g/mol=1mol,因此17g甲基(—14CH3)所含的中子数为8NA,B错误;
C.Na2CO3溶液中会有少量CO32-发生水解,因此在含CO32-总数为NA的Na2CO3溶液中,溶质的总量大于1mol,所以Na+总数大于2NA,C错误;
D.NO2与水反应的方程式为:3NO2+H2O=2HNO3+NO,在该反应中NO2既是氧化剂,又是还原剂,与转移的电子数的关系为:3NO2~2e-,13.8NO2的物质的量为13.8g÷46g/mool=0.3mol,则转移的电子为0.2mol,故D正确。
答案:D。


科目:高中化学 来源: 题型:
【题目】C60、金刚石和石墨的结构模型如图所示(石墨仅表示出其中的一层结构):

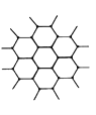
(1)C60、金刚石和石墨三者的关系是互为________。
A.同分异构体 B.同素异形体 C.同系物 D.同位素
(2)固态时,C60属于___(填“离子”、“原子”或“分子”)晶体,C60分子中含有双键的数目是___。
(3)硅晶体的结构跟金刚石相似,1 mol硅晶体中含有硅硅单键的数目约是______NA个。
(4)石墨层状结构中,平均每个正六边形占有的碳原子数是________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丁基甲酸是重要的有机合成中间体,其一种合成路线如下:

请回答下列问题:
(1)环丁基甲酸的分子式为____________________。
(2)环丁基甲酸由原料A和D经一系列反应制得,A为烯烃,则A的名称为______,D物质的官能团为_______。
(3)写出D→E的化学方程式________________________。
(4)C+E→F的反应类型为_________________________。
(5)化合物W为H的同分异构体,能发生银镜反应且只含酯基一种官能团,则所有符合条件的W的结构简式为_____________。
(6)参照上述合成路线,以 ![]() 和E为原料(无机试剂任选),设计制备
和E为原料(无机试剂任选),设计制备![]() 的合成路线:__________。
的合成路线:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴定实验是化学学科中重要的定量实验。
请回答下列问题:
(1)酸碱中和滴定——用标准盐酸滴定未知浓度的NaOH溶液,下列操作造成测定结果偏高的是 (填选项字母)
A.滴定终点读数时,俯视滴定管刻度,其他操作正确。
B.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,滴定管尖嘴有气泡,滴定后气泡消失
(2)氧化还原滴定——取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol·L-1的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。表格中记录了实验数据:
滴定次数 | 待测液体积 | 标准KMnO4溶液体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 25.00 | 0.50 | 20.40 |
第二次 | 25.00 | 3.00 | 23.00 |
第三次 | 25.00 | 4.00 | 24.10 |
①滴定时,KMnO4溶液应装在 (填“酸”或“碱”)式滴定管中,滴定终点时滴定现象是
②该草酸溶液的物质的量浓度为_____________。
(3)沉淀滴定――滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。
参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是 (填选项字母)。
难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
A.NaCl B.NaBr C.NaCN D.Na2CrO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业采用氯化铵焙烧菱锰矿制备高纯碳酸锰的流程如图所示:
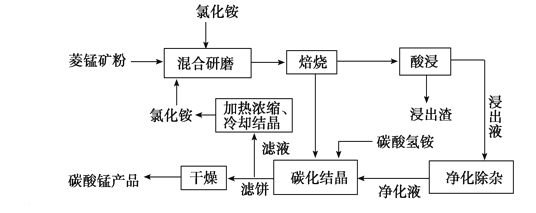
已知:①菱锰矿的主要成分是MnCO3,其中含Fe、Ca、Mg、Al等元素。
②Al3+、Fe3+沉淀完全的pH分别为4.7、3.2,Mn2+、Mg2+开始沉淀的pH分别为8.1、9.1。
③焙烧过程中主要反应为MnCO3+2NH4Cl ![]() MnCl2+2NH3↑+CO2↑+H2O。
MnCl2+2NH3↑+CO2↑+H2O。
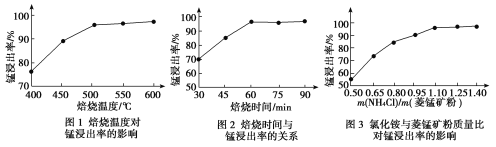
(1)结合图1、2、3,分析焙烧过程中最佳的焙烧温度、焙烧时间、m(NH4Cl)/m(菱锰矿粉)分别为____________、____________、____________。
(2)对浸出液净化除杂时,需先加入MnO2将Fe2+转化为Fe3+,再调节溶液pH的范围__,将Fe3+和Al3+变为沉淀而除去,然后加入NH4F将Ca2+、Mg2+变为氟化物沉淀除去。
(3)“碳化结晶”步骤中,加入碳酸氢铵时反应的离子方程式为____。
(4)上述流程中可循环使用的物质是________。
(5)现用滴定法测定浸出液中Mn2+的含量。实验步骤:称取1.000 g试样,向其中加入稍过量的磷酸和硝酸,加热使反应2Mn2++NO3-+4PO43-+2H+![]() 2[Mn(PO4)2]3-+NO2-+H2O充分进行并除去多余的硝酸;加入稍过量的硫酸铵,发生反应NO2-+NH4+===N2↑+2H2O以除去NO2-;加入稀硫酸酸化,用2.00 mol·L-110.00 mL硫酸亚铁铵标准溶液进行滴定,发生的反应为[Mn(PO4)2]3-+Fe2+===Mn2++Fe3++2PO43-;用0.10 mol·L-110.00 mL酸性K2Cr2O7溶液恰好除去过量的Fe2+。
2[Mn(PO4)2]3-+NO2-+H2O充分进行并除去多余的硝酸;加入稍过量的硫酸铵,发生反应NO2-+NH4+===N2↑+2H2O以除去NO2-;加入稀硫酸酸化,用2.00 mol·L-110.00 mL硫酸亚铁铵标准溶液进行滴定,发生的反应为[Mn(PO4)2]3-+Fe2+===Mn2++Fe3++2PO43-;用0.10 mol·L-110.00 mL酸性K2Cr2O7溶液恰好除去过量的Fe2+。
①酸性K2Cr2O7溶液与Fe2+反应(还原产物是Cr3+)的离子方程式为___________。
②试样中锰的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某种微生物燃料电池工作原理如图所示。下列有关该电池的说法中,正确的是

A.外电路电子从B极移向A极
B.溶液中H+由B极区移向A极区
C.电池工作一段时间后B极区溶液的pH减小
D.A极电极反应式为:CH3COOH - 8e-+2H2O=2CO2 +8H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,1mol/L的HA和1mol/L的HB两种酸溶液,起始时的体积均为V0,分别向两溶液中加水进行稀释,所得变化关系如图所示(V表示溶液稀释后的体积)。下列说法错误的是
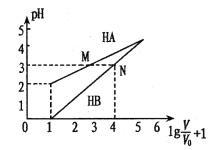
A. Ka( HA)约为10-4
B. 当两溶液均稀释至![]() 时,溶液中
时,溶液中![]() >
>![]()
C. 中和等体积pH相同的两种酸所用n(NaOH):HA>HB
D. 等体积、等物质的量浓度的NaA和NaB溶液中离子总数前者小于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,其性质和制备受到人们的关注。一定温度下,在2 L固定容积的密闭容器中发生反应:2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列说法中不正确
4NO2(g)+O2(g) ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列说法中不正确
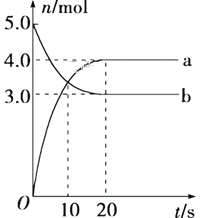
A. 曲线a表示NO2的物质的量随时间的变化
B. 10 s时,v(正)>v(逆)
C. 20 s时反应达到平衡
D. 0~20 s内平均反应速率 v(O2)=0.05 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中钌(Ru)与铁相邻位于铁的下一周期,某钌光敏太阳能电池的工作原理如下图所示,图中RuII*表示激发态。下列说法正确的是( )
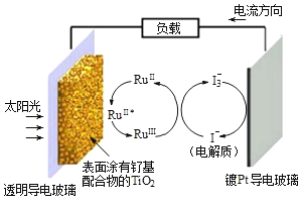
A. 电池工作时,直接将太阳能转化为电能
B. 镀铂导电玻璃的作用是传递I-
C. 电池的电解质溶液中I- 和I3-的浓度不断减小
D. 电解质溶液中发生反应:2Ru3+ + 3I-= 2Ru2+ + I3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com