
 乙醇在一定的条件下发生化学反应时,化学键断裂的情况如图所示.当乙醇和氧气发生催化氧化时,化学键断裂的位置是 ( )
乙醇在一定的条件下发生化学反应时,化学键断裂的情况如图所示.当乙醇和氧气发生催化氧化时,化学键断裂的位置是 ( )| A. | 2 3 | B. | 2 4 | C. | 1 3 | D. | 3 4 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
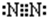 ,其中的化学键属于共价键(填“离子”或“共价”).
,其中的化学键属于共价键(填“离子”或“共价”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 醋氯芬酸是新合成的一种抗炎、解热、镇痛的口服药物,结构简式如图所示,下列有关它的说法不正确的是( )
醋氯芬酸是新合成的一种抗炎、解热、镇痛的口服药物,结构简式如图所示,下列有关它的说法不正确的是( )| A. | 该药品的分子式是C16H13O4NCl2 | |
| B. | 1mol有机物与NaOH溶液反应最多消耗2mol氢氧化钠 | |
| C. | 1mol该有机物与氢气反应最多消耗6mol氢气 | |
| D. | 能与NaHCO3发生反应生成气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (NH4)2Fe(SO4)2溶液中:Ba2+、K+、OH-、Br- | |
| B. | 通入过量SO2气体的溶液中:Fe3+、NO3-、Ba2+、H+ | |
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=10-12的溶液中:NH4+、Cu2+、NO3-、Cl- | |
| D. | c(I-)=0.1 mol•L-1的溶液中:Na+、Fe3+、ClO-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com