
【题目】甲酸是基本有机化工原料之一,广泛用于农药、皮革、染料、医药和橡胶等工业。
(1)已知热化学反应方程式:
I:HCOOH(g)![]() CO(g)+H2O(g) △H1=+72.6kJmol-1;
CO(g)+H2O(g) △H1=+72.6kJmol-1;
II:2CO(g)+O2(g)![]() 2CO2(g) △H 2=-566.0kJmol-1;
2CO2(g) △H 2=-566.0kJmol-1;
III:2H2(g)+O2(g)![]() 2H2O(g) △H 3=-483.6kJmol-1
2H2O(g) △H 3=-483.6kJmol-1
则反应IV:CO2(g)+H2(g)![]() HCOOH(g)的△H =____________kJmol-1。
HCOOH(g)的△H =____________kJmol-1。
(2)查阅资料知在过渡金属催化剂存在下,CO2(g)和H2 (g)合成HCOOH(g)的反应分两步进行:第一步:CO2(g)+H2(g)+M(s)→MHCOOH(s);第二步:___________________。
①第一步反应的△H _________0(填“>”或“<”)。
②第二步反应的方程式为________________________。
③在起始温度、体积都相同的甲、乙两个密闭容器中分别投入完全相同的H2(g)和CO2(g),甲容器保持恒温恒容,乙容器保持绝热恒容,经测定,两个容器分别在t1、t2时刻恰好达到平衡,则t1_________t2(填“>”、“<”或“=”)。
(3)在体积为1L的恒容密闭容器中,起始投料n(CO2)=1mol,以CO2(g)和H2(g)为原料合成HCOOH(g),HCOOH平衡时的体积分数随投料比[ ]的变化如图所示:
]的变化如图所示:

①图中T1、T2表示不同的反应温度,判断T1____________T2(填“〉”、“<”或“=” ) ,依据为____________________。
②图中a=______________。
③A、B、C三点CO2(g)的平衡转化率αA、αB、αC由大到小的顺序为____________。
④T1温度下,该反应的平衡常数K=______________(计算结果用分数表示)。
【答案】-31.4 < M·HCOOH(s)=HCOOH(g)+M(s) > < 该反应为放热反应,升高温度,平衡逆向移动,从图像中可知在相同投料比时,T1温度下产物的体积分数大于T2温度下产物的体积分数,则T1< T2; 1 ![]() >
>![]() >
>![]()
![]()
【解析】
(1)根据盖斯定律进行求算;
(2)①由△G=△H -T△S <0进行判断;
②总反应减去第一步反应可得第二步反应的方程式;
③甲容器恒温恒容,乙容器恒容绝热,由于该反应放热,所以乙容器的温度高于甲容器,所以乙容器反应速率较快,所以甲容器中反应达平衡所需时间比乙容器中的长;
(3)①该反应为放热反应,升高温度,平衡逆向移动;
②根据反应CO2(g)+H2(g)![]() HCOOH(g)及投料比[
HCOOH(g)及投料比[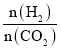 ]进行分析;
]进行分析;
③氢气的量越大,即投料比[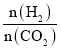 ]越大,CO2的转化率越大;
]越大,CO2的转化率越大;
④根据三段式进行计算。
(1)已知I:HCOOH(g)![]() CO(g)+H2O(g) △H1=+72.6kJmol-1;
CO(g)+H2O(g) △H1=+72.6kJmol-1;
II:2CO(g)+O2(g)![]() 2CO2(g) △H 2=-566.0kJmol-1;
2CO2(g) △H 2=-566.0kJmol-1;
III:2H2(g)+O2(g)![]() 2H2O(g) △H 3=-483.6kJmol-1
2H2O(g) △H 3=-483.6kJmol-1
根据盖斯定律,由III![]() -I- II
-I- II![]() 得反应IV:CO2(g)+H2(g)
得反应IV:CO2(g)+H2(g)![]() HCOOH(g) △H = (-483.6kJmol-1)
HCOOH(g) △H = (-483.6kJmol-1)![]() -72.6kJmol-1- (-566.0kJmol-1)
-72.6kJmol-1- (-566.0kJmol-1)![]() =-31.4kJmol-1;
=-31.4kJmol-1;
(2)①第一步反应CO2(g)+H2(g)+M(s)→MHCOOH(s)为熵减的反应,即△S<0,能自发进行,则△G=△H -T△S <0,故△H<0;
②CO2(g)和H2 (g)合成HCOOH(g)的总反应为CO2(g)+H2(g)![]() HCOOH(g);第一步:CO2(g)+H2(g)+M(s)=MHCOOH(s);总反应减去第一步反应可得第二步反应的方程式为M·HCOOH(s)=HCOOH(g)+M(s);
HCOOH(g);第一步:CO2(g)+H2(g)+M(s)=MHCOOH(s);总反应减去第一步反应可得第二步反应的方程式为M·HCOOH(s)=HCOOH(g)+M(s);
③甲容器恒温恒容,乙容器恒容绝热,由于该反应放热,所以乙容器的温度高于甲容器,所以乙容器反应速率较快,所以甲容器中反应达平衡所需时间比乙容器中的长,则t1>t2;
(3)①该反应为放热反应,升高温度,平衡逆向移动,从图像中可知在相同投料比时,T1温度下产物的体积分数大于T2温度下产物的体积分数,则T1< T2;
②根据反应CO2(g)+H2(g)![]() HCOOH(g),当投料比[
HCOOH(g),当投料比[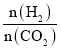 ]=1,即a=1时,恰好达到最大转化,HCOOH平衡时的体积分数最大;
]=1,即a=1时,恰好达到最大转化,HCOOH平衡时的体积分数最大;
③氢气的量越大,即投料比[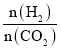 ]越大,CO2的转化率越大,故A、B、C三点CO2(g)的平衡转化率αA、αB、αC由大到小的顺序为
]越大,CO2的转化率越大,故A、B、C三点CO2(g)的平衡转化率αA、αB、αC由大到小的顺序为![]() >
>![]() >
>![]() ;
;
④T1温度下,在体积为1L的恒容密闭容器中,起始投料n(CO2)=1mol,C点时投料比[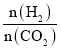 ]=2,则n(H2)=2mol,HCOOH平衡时的体积分数为5%,设平衡时CO2转化率为x,则:
]=2,则n(H2)=2mol,HCOOH平衡时的体积分数为5%,设平衡时CO2转化率为x,则:
CO2(g)+H2(g)![]() HCOOH(g)
HCOOH(g)
开始时的浓度(mol/L) 1 2 0
改变的浓度(mol/L) x x x
平衡时的浓度(mol/L)1-x 2-x x
则有![]() ,解得x=
,解得x=![]() ;该反应的平衡常数K=
;该反应的平衡常数K=![]() =
=![]() 。
。


科目:高中化学 来源: 题型:
【题目】下表中实线是元素周期表的部分边界,其中上边界并未用实线标出。
根据信息回答下列问题:
(1)周期表中基态Ga原子的电子排布式为___。
(2)Fe元素位于周期表的___分区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为___。
(3)已知:原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为___和___(填化学式)。在CO、CH3OH中,碳原子采取sp3杂化的分子有___。
(4)根据VSEPR理论预测ED4-离子的空间构型为___。B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子有__(任写2种化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石的主要成分为Cu2(OH)2CO3。某同学设计的从孔雀石中冶炼铜的方案如下(假设孔雀石中杂质不溶于水和稀硫酸):

(1)反应①能观察到的现象是__________,有关反应的化学方程式为________。
(2)反应②加入的金属可能是______,有关反应的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
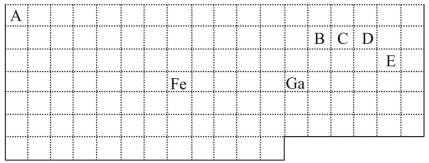
【题目】在1.0 L恒容密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g)![]() Y(g)+Z(g) ΔH<0,容器内气体总压强p随反应时间t的变化关系如图所示。以下分析正确的是 ( )
Y(g)+Z(g) ΔH<0,容器内气体总压强p随反应时间t的变化关系如图所示。以下分析正确的是 ( )
A. 该温度下此反应的平衡常数K=3.2
B. 从反应开始到t1时的平均反应速率v(X)=0.2/t1 mol·L-1·min-1
C. 欲提高平衡体系中Y的百分含量,可加入一定量的X
D. 其他条件不变,再充入0.1 mol气体X,平衡正向移动,X的转化率减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国研制出非贵金属镍钼基高效电催化剂,实现电解富尿素废水低能耗制H2(装置如图)。总反应为CO(NH2)2+H2O=3H2↑+N2↑+CO2↑。下列说法中错误的是

A. a为阳极,CO(NH2)2发生氧化反应
B. b电极反应为:2H2O+2e-=H2↑+2OH-
C. 每转移6mol电子,a电极产生1molN2
D. 电解一段时间,a极区溶液pH升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期元素Q位于ds区,最外层电子半充满;短周期元素W、X、Y、Z第一电离能与原子序数的关系如下图所示,请回答下列问题(用Q、W、X、Y、Z所对应的元素符号作答):

(1)基态Y原子核外共有___种运动状态不相同的电子。若用n表示能层,则与Y元素同族的元素的基态原子的价电子排布式为_________________。
(2)X、W组成的一种二元化合物常用作火箭燃料,该化合物中X原子的杂化方式为___________。该化合物常温下呈液态,其沸点高于Y2沸点的原因为___________。
(3)X2Y曾被用作麻醉剂,根据“等电子体原理”预测X2Y的空间构型为______________。
(4)XW3存在孤电子对,可形成[Q(XW3)4]2+离子,该离子中不存在_____________(填序号)。
A.极性共价键 B.非极性共价键 C.配位键 D.σ键 E.π键
(5)Q与X形成的一种二元化合物的立方晶胞结构如图所示:
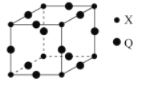
①Q原子周围距其距离最近的Q原子的数目为_______。
②该二元化合物的化学式为___________________。
(6)已知单质Q晶体的堆积方式为面心立方最密堆积,则单质Q晶体的晶胞中原子的空间利用率为_________________(用含π的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10﹣5 | Ka1=4.3×10﹣7 Ka2=5.6×10﹣11 | Ka=3.0×10﹣8 |
(1)物质的量浓度均为0.1molL﹣1的四种溶液:pH由小到大排列的顺序是_______(用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1molL﹣1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是_____(填字母)_______
A. c(H+) B.![]() C. c(H+)c(OH﹣) D.
C. c(H+)c(OH﹣) D. ![]() E.
E. ![]()
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:__________________
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中
c(CH3COO﹣)﹣c(Na+)=________(填准确数值)。
(5)25℃时,将a molL﹣1的醋酸与b molL﹣1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为____________________________________
(6)标准状况下,将1.12L CO2通入100mL 1molL﹣1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式: c(OH﹣)=2c(H2CO3)+_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组所做实验的示意图如图所示:图中“→”表示气体流向, M是一种纯净而干燥的气体,Y为另一种气体,E内有红棕色气体产生,实验所用物质只能由下列物质中选取:Na2CO3、Na2O2、NaCl、Na2O、CaCl2、(NH4)2CO3、碱石灰等固体及蒸馏水。据此实验,完成下列填空:
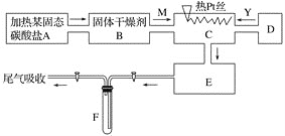
(1)A中所用装置的主要仪器和药品是______________________。
(2)B中所选的干燥剂是________,其作用是______________________________。
(3)C中发生的主要反应的化学方程式:________________________________。
(4)制取Y气体的D装置所用的主要仪器是__________________________。
制取Y气体的化学方程式是________________________。
(5)F中发生反应的化学方程式为__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com