
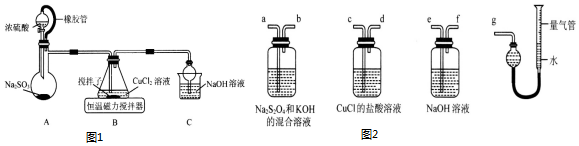
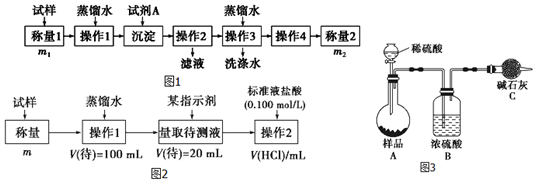
分析 图1:A装置准备二氧化硫,B中盛放氯化铜溶液,与二氧化硫反应得到CuCl:SO2+2Cu2++2Cl-+2H2O=2CuCl↓+4H++SO42-,C装置盛放氢氧化钠溶液,吸收未反应的二氧化硫,防止污染空气,同时防止倒吸;装置B中反应结束后,取出混合物进行冷却、过滤、水洗、醇洗、干燥,得到CuC1晶体,CuCl难溶于水、稀盐酸和乙醇,除去CuCl的铜,可加入盐酸,利用浓盐酸溶解CuCl生成H3CuCl4,过滤分离,再用水稀释后过滤分离,以此分析(1)、(2);
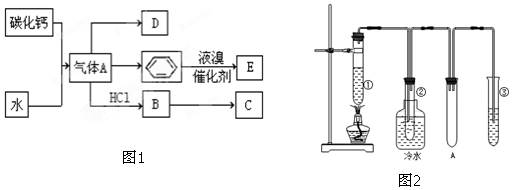
(3)①保险粉(Na2S2O4)和KOH的混合溶液能吸收氧气,该试剂可吸收二氧化碳,故先检验二氧化碳,CuCl的盐酸溶液能吸收CO形成Cu(CO)Cl•H2O,其中盐酸挥发出的氯化氢气体干扰对二氧化碳和氧气的检验,故先检验氧气,最后吸收氮气,据此分析;
②Na2S2O4在碱性条件下吸收氧气,发生氧化还原反应生成硫酸钠与水.
解答 解:(1)①装置A中橡胶管的作用是维持烧瓶内压强与分液漏斗内压强相等,使液体能顺利流下;
故答案为:维持烧瓶内压强与分液漏斗内压强相等,使液体能顺利流下;
②B中盛放氯化铜溶液,与二氧化硫反应得到CuCl,铜元素化合价降低,则二氧化硫中硫元素化合价升高,生成硫酸根离子,离子反应为:SO2+2Cu2++2Cl-+2H2O=2CuCl↓+4H++SO42-;
故答案为:SO2+2Cu2++2Cl-+2H2O=2CuCl↓+4H++SO42-;
③C装置盛放氢氧化钠溶液,吸收SO2尾气,防止污染空气;其中的干燥管同时防倒吸;
故答案为:吸收SO2尾气,防止污染空气,同时防倒吸;
(2)①由题氯化亚铜难溶于乙醇,乙醇具有易挥发,有利于加快去除CuCl表面水分,防止其被氧化;
故答案为:有利于加快去除CuCl表面水分,防止其被氧化;
②由于CuCl见光分解、露置于潮湿空气中易被氧化,应避光、密封保存;
故答案为:密封、遮光保存;
③提纯某混有铜粉的CuCl晶体实验方案:将固体溶于浓盐酸后过滤,去滤液加入大量的水稀释,过滤、洗涤、干燥得到CuCl;
故答案我为:将固体溶于浓盐酸后过滤,取滤液加大量水,过滤、洗涤,干燥;
(3)①保险粉(Na2S2O4)和KOH的混合溶液能吸收氧气,该试剂可吸收二氧化碳,故先检验二氧化碳,CuCl的盐酸溶液能吸收CO形成Cu(CO)Cl•H2O,其中盐酸挥发出的氯化氢气体干扰对二氧化碳和氧气的检验,故先检验氧气,最后吸收氮气,为保证气体充当=分吸收,导气管均应长进短出,故连接顺序为:e→f→a→b→c→d→g;
故答案为:e→f→a→b→c→d→g;
②Na2S2O4在碱性条件下吸收氧气,发生氧化还原反应生成硫酸钠与水,反应离子方程式为:2S2O42-+3O2+4OH-=4SO42-+2H2O;
故答案为:2S2O42-+3O2+4OH-=4SO42-+2H2O;
点评 本题考查物质制备实验,为高考常见题型,侧重考查学生对信息获取与迁移运用,关键是对原理的理解,需要学生具备扎实的基础,难度不大.


科目:高中化学 来源: 题型:实验题
 ;
; ,其反应类型为加聚反应.
,其反应类型为加聚反应.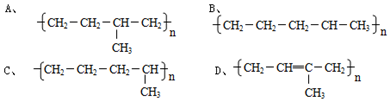
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单晶硅制芯片 | B. | SiO2制光导纤维 | ||
| C. | 金刚砂(碳化硅)作砂轮的磨料 | D. | 水玻璃作黏合剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
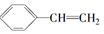 )的下列叙述,其中正确的是( )
)的下列叙述,其中正确的是( )| A. | ①②④⑤ | B. | ①②⑤⑥⑦ | C. | ①②④⑤⑥ | D. | ①②③④⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸化学式 | CH3COOH | HCN | H2S |
| 电离常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=1.3×10-7K2=7.l×10-15 |
| A. | 等物质的量浓度的各溶液pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN) | |
| B. | CH3COONa溶液中,其水解平衡常数K=Kw×10-5 | |
| C. | NaHS 和 Na2S混合溶液中,存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) | |
| D. | 某浓度NaCN的水溶液pH=d,则其中c(OH-)=10-d mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
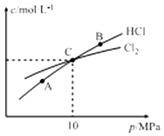 氯氨是氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2C1、NHC12和NC13),副产物少于其它水消毒剂.
氯氨是氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2C1、NHC12和NC13),副产物少于其它水消毒剂.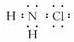 .
.| 化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
| 键能(kJ/mol) | 391.3 | 243.0 | 191.2 | 431.8 |
| t/min | 0 | 40 | 80 | 120 | 160 |
| n(Cl2)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| n(Cl2)(乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2-甲基丁烷也称异丁烷 | |
| B. | 由乙烯生成乙醇属于加成反应 | |
| C. | C4H9Cl有3种同分异构体 | |
| D. | 用长颈漏斗分离出乙酸与乙醇反应的产物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com