
分析 (1)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(2)设SO2的变化浓度是x,则
2SO2(g)+O2(g)?2SO3(g)
初始物质的量:0.4 0.2 0
变化物质的量:x 0.5x x
平衡物质的量:0.4-x 0.2-0.5x x
当反应达到平衡时,容器内压强变为起始时的0.7倍,则$\frac{0.4-x+0.2-0.5x+x}{0.4+0.2}$=0.7,解得x=0.36mol,
①转化率=$\frac{消耗量}{起始量}$×100%;
②依据热化学方程式定量关系和实际消耗二氧化硫的物质的量计算反应放出的热量;
③平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
(3)化学反应速率的定义求出氧气的速率;根据影响化学平衡的因素来判断平衡移动方向,利用极限法求出再次达平衡后n(SO3)的范围.
解答 解:(1)a、SO2、O2、SO3三者的浓度之比为2:1:2的状态也可能不符合Qc=K的结论,也可能符合,这不是平衡的标志,故a错误;
b、反应是一个前后气体系数变化的反应,容器内气体的压强不变,证明达到了平衡,故b正确;
c、容器内混合气体的密度始终保持不变,所以密度不变不一定平衡,故c错误;
d、SO3的物质的量不再变化即浓度不再变化是平衡的特征,故d正确;
e、SO2的生成速率和SO3的生成速率相等,说明正逆反应速率相等,达到了平衡,故e正确.
故答案为:bde;
(2)设SO2的变化浓度是x,则
2SO2(g)+O2(g)?2SO3(g)
初始物质的量:0.4 0.2 0
变化物质的量:x 0.5x x
平衡物质的量:0.4-x 0.2-0.5x x
当反应达到平衡时,容器内压强变为起始时的0.7倍,则$\frac{0.4-x+0.2-0.5x+x}{0.4+0.2}$=0.7,解得x=0.36mol,
①所以二氧化硫的转化率=$\frac{0.36mol}{0.4mol}$×100%=90%,
故答案为:90%;
②2SO2(g)+O2 (g)?2SO3 (g)△H=-196kJ/mol,反应过程中消耗二氧化硫物质的量2mol放热196KJ,上述计算二氧化硫消耗物质的量为0.36mol,放出热量=$\frac{0.36mol}{2mol}×196KJ$=35.28KJ,
故答案为:35.28KJ;
③平衡常数K=$\frac{(\frac{0.36mol}{5L})^{2}}{(\frac{0.4mol-0.36mol}{5L})^{2}×\frac{0.2mol-0.5×0.36mol}{5L}}$=20250,
故答案为:20250;
(3)当生成0.18molSO3时,参加反应的氧气的物质的量为x,
2SO2(g)+O2(g)?2SO3(g)
1 2
x 0.18mol
x=$\frac{0.18mol×1}{2}$=0.09mol
v(O2)=$\frac{\frac{0.09mol}{5L}}{0.5min}$=0.036mol.L-1•min-1;
继续通入0.20mol SO2和0.10mol O2,容器内压强增大,平衡向气体体积减小的方向移动,即向正反应方向移动;
用极限法求出n(SO3)的范围,
假设平衡不移动,此时n(SO3)=0.18×2=0.36mol,
假设0.40molSO2完全生成SO3,根据反应方程式2SO2(g)+O2(g)?2SO3(g)可知,n(SO3)=0.4mol,
所以再次达到平衡时,0.36mol<n(SO3)<0.40mol.
故答案为:0.036;向正反应方向; 0.36mol<n(SO3)<0.40mol.
点评 本题考查了化学平衡状态的判断以及化学平衡的计算知识、反应速率和平衡常数的计算,题目难度中等,注意影响平衡的因素,掌握基础是解题关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜长期放置在潮湿的空气中容易生锈,生成Cu(OH)2 | |
| B. | 铜丝在氯气中燃烧生成CuCl2而与硫反应生成Cu2S,说明氧化性Cl2>S | |
| C. | CuO不及Cu2O稳定,高温条件下CuO可以分解生成Cu2O和氧气 | |
| D. | 蓝色的CuSO4•5H2O可以受热分解转化为白色的CuSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| R | 原子最外层电子数是电子总数的$\frac{2}{3}$ |
| X | 单质不能将比它不活泼的金属从其盐溶液中置换出来 |
| Y | 第三周期原子半径最小的金属 |
| Z | 单质是淡黄色固体 |
| A. | R的最高价氧化物既能与某种非金属单质反应,又能与某种金属单质反应 | |
| B. | X、Y、Z的氧化物分别投入NaOH溶液中一定都能发生反应 | |
| C. | X、Y、Z的原子半径依次减小,离子半径依次增大 | |
| D. | X、Y、Z的最高价氧化物对应水化物之间可以两两反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与Y只能形成一种化合物 | |
| B. | 最高价氧化物对应水化物的酸性:N>M | |
| C. | 单质与水反应的剧烈程度:Z>Y | |
| D. | X和M的最高正价相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 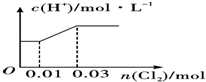 | B. |  | ||
| C. | 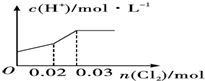 | D. | 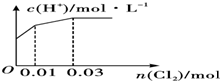 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+,NH4+,NO3-MnO4- | B. | Mg2+,SO42-,K+,Cl- | ||
| C. | K+,Cu2+,Cl-,Br- | D. | Ba2+,Na+,OH-,HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
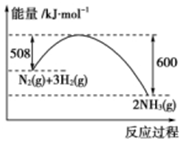 根据下列叙述写出相应的热化学方程式:
根据下列叙述写出相应的热化学方程式:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com