
氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液。向该溶液中通入二氧化碳,有下列反应: 2NaAl(OH)4+CO2→2Al(OH)3↓ +Na2CO3+H2O
(1)上述五中物质中沸点最低物质的结构式为______________,由上述物质中的两种元素按原子个数比1:1形成的离子化合物的电子式为__________________(写一例)
(2)Al元素的单质有许多不同于其他金属的特性,请列举2例(也可以用化学方程式表示)
______________________、__________________________________.
(3)氢有3种稳定同位素,H氕、 D氘、 T氚,分别为丰度a、b、c,则计算氢元素的近似相对原子质量的表达式为______________________________________________.
甲认为H可以排在周期表ⅠA族,也可以排在ⅦA族;而乙同学认为H也可以与碳一样,排在ⅣA族,乙同学的理由是__________________________________________________。
(4)己知通入二氧化碳336 L(标准状况下),理论上生成Al(OH)3 ________________mol,
实际上生成24 mol Al(OH)3和15 mol Na2CO3,Al(OH)3比理论上要少的原因是:________________________________________________________.
(1)O=C=O 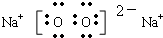 或 Na+[:H]- (2分)
或 Na+[:H]- (2分)
(2)被浓硫酸或浓硝酸钝化,能与强碱溶液反应放出氢气,发生铝热反应答出2例即可。
(2分)
(3)a+2b+3c ,最高正价与最低负价数值上相等(H的化合价+1,-1与碳+4,-4相似)(2分)
(4)30 ,氢氧化钠溶液处理铝土矿时,氢氧化钠过量,(铝酸钠的溶液中含有NaOH)并于CO2反应生成Na2CO3(2分)
【解析】
试题分析:
(1)通常状况下,五种物质中只有CO2为气态,沸点最低;这五种物质中含有Na、Al、O、H、C五种元素,两种元素按原子个数比1:1形成的离子化合物有Na2O2、NaH。
(2)对比Al与其他金属的性质,答出Al的特性即可。
(3)元素的相对原子质量等于各同位素的相对原子质量乘以风度,然后求和;碳的最高正价为+4,最低负价为-4,H的最高正价为+1,最低负价为-1,绝对值相等。
(4)根据化学方程式可得:n[Al(OH)3]=2n(CO2)=2×336L÷22.4L/mol=30mol,上一步处理所用NaOH溶液是过量的,剩余的NaOH与CO2反应生成Na2CO3。
考点:本题考查结构式与电子式的书写、重要物质的性质、相对原子质量的计算、产量的计算。


科目:高中化学 来源: 题型:
| 铵盐的质量/g | 10.00 | 20.00 | 30.00 | 50.00 |
| 浓硫酸增加的质量/g | m | m | 1.29 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。
完成下列计算:
57.叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊。若产生40.32 L(标准状况下)氮气,至少需要叠氮化钠___g。
58.钠-钾合金可在核反应堆中用作热交换液。5.05 g钠-钾合金溶于200 mL水生成0.075 mol氢气。
(1)计算溶液中氢氧根离子的物质的量浓度(忽略溶液体积变化)。
(2)计算并确定该钠-钾合金的化学式。
59.氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液。向该溶液中通入二氧化碳,有下列反应:
2NaAl(OH)4+CO2→2Al(OH)3↓ +Na2CO3+H2O
己知通入二氧化碳336 L(标准状况下),生成24 mol Al(OH)3和15 mol Na2CO3,若通入溶液的二氧化碳为112L(标准状况下),计算生成的Al(OH)3和Na2CO3的物质的量之比。
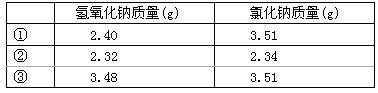
60.常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失。
|
| 氢氧化钠质量(g) | 氯化钠质量(g) |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |
上述实验①②③所用氢氧化钠均不含杂质,且实验数据可靠。通过计算,分析和比较上表3组数据,给出结论。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年上海市长宁区高三上学期期末教学质量调研化学试卷(解析版) 题型:计算题
钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。
完成下列计算:
(1)叠氮化钠(NaN3)受撞击分解产生钠和氮气,故可应用于汽车安全气囊。若78克叠氮化钠完全分解,产生标准状况下氮气___________________L 。
(2)钠-钾合金可在核反应堆中用作热交换液。5.05 g钠-钾合金溶于200 mL水生成0.075 mol氢气。计算溶液中氢氧化钠的物质的量浓度______________________(忽略液体体积变化)。
(3)氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液。向该溶液中通入二氧化碳,有下列反应: 2NaAl(OH)4+CO2→2Al(OH)3↓+Na2CO3+H2O。己知通入二氧化碳112 L(标准状况下),生成的Al(OH)3和Na2CO3的物质的量之比为4:5。若向该溶液中通入的二氧化碳为224L(标准状况下),计算生成的 Al(OH)3和Na2CO3的物质的量的最大值。
(4)为测定某硫酸吸收含氨气废气后,所得铵盐中氮元素的质量分数,现将不同质量的铵盐固体分别加入到50.00mL相同浓度的氢氧化钠溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。部分测定结果如下表:
|
铵盐的质量/g |
10.00 |
20.00 |
30.00 |
50.00 |
|
浓硫酸增加的质量/g |
m |
m |
1.29 |
0 |
试回答:
该铵盐的成分为_______________________________。
该铵盐中氮元素的质量分数为:_______________________________(须列式计算)。
查看答案和解析>>
科目:高中化学 来源:上海高考真题 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com