
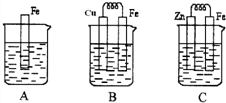
 如图A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.
如图A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.

科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C分别选自下列溶液:0.1 mol·L-1盐酸、0.1 mol·L-1醋酸、0.1 mol·L-1 NaCl溶液、0.1 mol·L-1 NaOH溶液、0.1 mol·L-1氨水。且25 ℃时,A溶液pH<7。
完成下列问题:
(1)指出A、B、C是(或可能是)什么溶液?A.________;B.________;C.________。
(2)若向C溶液中滴入酚酞试剂呈红色,则C是________;将A、B、C分别以等体积进行两两混合,结果是哪种组合的混合液中,水的电离程度最大?________(选填A、B、C回答)。
查看答案和解析>>
科目:高中化学 来源: 题型:
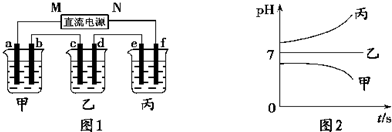
A、B、C三种强电解质,它们在水中电离出的离子为Na+ 、Ag+ 、NO3- 、SO42- 、 Cl-,在如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、 B、 C三种溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙烧杯中c电极质量增加了10.8克。常温下各烧杯中溶液的pH与电解时间t的关系如图所示。据此回答下列问题:
(1)M为电源的_______极(填写“正”或“负”),甲、乙两个烧杯中的电解质分别为_______、_______(填写化学式)。
(2)计算电极f上生成的气体为_______mol。
(3)写出乙烧杯中的电解反应方程式:_______________________________________。
(4)若电解后甲溶液的体积为10L,则该溶液的pH为___________。
(5)要使丙恢复到原来的状态,应加入适量的 (填写化学式)。
查看答案和解析>>
科目:高中化学 来源:2015届吉林省白山市高二上学期期末考试化学试卷(解析版) 题型:填空题
A、B、C三种强电解质,它们在水中电离出的离子为Na+、Ag+、NO3-、SO42-、Cl-,在如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、C三种溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙烧杯中c电极质量增加了10.8克。常温下各烧杯中溶液的pH与电解时间t的关系如图所示。据此回答下列问题:
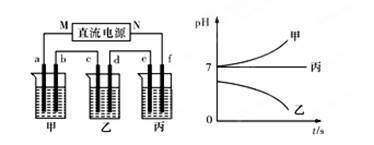
(1)M为电源的 极(填写“正”或“负”),甲、乙两个烧杯中的电解质分别为 、 (填写化学式)。
(2)计算电极f上生成的气体在标准状况下体积为 L。
(3)写出乙烧杯中的电解反应方程式: 。
(4)若电解后甲溶液的体积为10L,则该溶液的pH为 。
查看答案和解析>>
科目:高中化学 来源:2013届四川省高二下学期期中考试化学试卷(解析版) 题型:填空题
A、B、C三种强电解质,它们溶于水在水中电离出的阳离子有K+、Ag+,阴离子有NO3-、OH-(电解质电离的离子有重复)。
图1装置中,甲、乙、丙三个烧杯中依次盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为铂电极。接通电源,经过一段时间后,测得甲中b电极质量增加了43.2g。常温下各烧杯中溶液pH与电解时间t关系如图2。请回答下列问题:
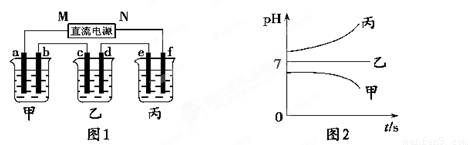
(1)写出三种强电解质的化学式:A ;B ;C 。
(2)写出乙烧杯c电极发生的电极反应为__________________________,甲烧杯中的总反应的化学方程式为___________________________________________。
(3)计算丙烧杯e电极上生成的气体在标准状况下的体积为________________,甲烧杯中溶液的pH= 。(假设溶液体积是400ml)
(4)要使甲烧杯中的A溶液恢复到电解前的状态,需要加入的物质是_____________,其质量为 。
(5)若直流电源使用的是铅蓄电池,铅蓄电池的正极材料是PbO2,负极材料是Pb,电解质溶液时H2SO4,则放电时N级上发生的电极反应为________________________________
____________________,M级附近溶液的pH (选填“升高”或“降低”或“不变”)。
铅蓄电池充电时,若阳极和阴极之间用阳离子交换膜(只允许H+通过)隔开,则当外电路通过0.2mol电子时,由阳极室通过阳离子交换膜进入阴极室的阳离子有 mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com