
【题目】常温下,向100 mL 0.2 mol·L-1的氨水中逐滴加入0.2 mol·L-1的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O的物质的量分数与加入盐酸的体积的关系如图所示。

根据图象回答下列问题。
(1)表示NH3·H2O浓度变化的曲线是_____(填“A”或“B”)。
(2)NH3·H2O的电离常数为_____。
(3)当加入盐酸体积为50 mL时,溶液中c(NH4+)-c(NH3·H2O)=___ mol·L-1(用数字表示)。
【答案】A 1.8×10—5(或10—4.74) 2×10—5-2×10-9
【解析】
(1)题干信息可知向100mL 0.2mo/L的氨水中逐滴加入0.2mol/L的盐酸,一水合氨浓度减小,据此分析;
(2)一水合氨电离平衡常数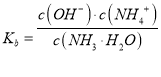 ,平衡常数只随温度变化,取pH=9.26时的浓度计算,此时c(NH4+)=c(NH3H2O),据此分析;
,平衡常数只随温度变化,取pH=9.26时的浓度计算,此时c(NH4+)=c(NH3H2O),据此分析;
(3)依据电荷守恒和物料守恒分析;
(1)常温下向100mL 0.2mo/L的氨水中逐滴加入0.2mol/L的盐酸,一水合氨浓度减小,表示NH3H2O浓度变化的曲线是A,
故答案为:A;
(2) NH3H2O的电离常数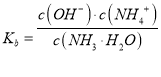 ,平衡常数只随温度变化,取pH=9.26时的浓度计算,此时c(NH4+)=c(NH3H2O),
,平衡常数只随温度变化,取pH=9.26时的浓度计算,此时c(NH4+)=c(NH3H2O),![]() ,
,![]() ,故答案为:1.8×105或104.74;
,故答案为:1.8×105或104.74;
(3)当加入盐酸体积为50mL时,此时溶液pH=9,溶液中存在等浓度的一水合氨、氯化铵,溶液中存在电荷守恒c(NH4+)+c(H+)=c(Cl)+c(OH)和物料守恒得到c(NH4+)+c(NH3·H2O)=2c(Cl),得到c(NH4+)-c(NH3·H2O)=2c(OH)2c(H+)=2×1052×109,
故答案为:2×1052×109。


科目:高中化学 来源: 题型:
【题目】一定条件下,密闭容器中发生反应Mg)N(g),反应过程中的能量变化如图中曲线所示,下列说法错误的是

A.该反应正反应活化能为E3-E2
B.该反应的△H=E1-E2
C.曲线Ⅱ表示其他条件不变,升高温度时的能量变化
D.曲线Ⅲ表示其他条件不变,加入催化剂时的能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石棉尾矿主要含有![]() 和少量的
和少量的![]() 、
、![]() 以石棉尾矿为镁源制备碳酸镁晶体
以石棉尾矿为镁源制备碳酸镁晶体![]() 的工艺如下:
的工艺如下:
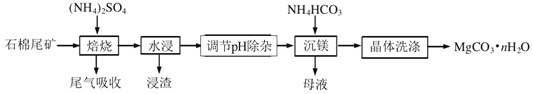
已知“焙烧”过程中的主反应为:![]()
![]() 写出焙烧产物
写出焙烧产物![]() 的电子式______。
的电子式______。
![]() 为提高水浸速率,可采取的措施为______
为提高水浸速率,可采取的措施为______![]() 任写一条
任写一条![]() ,“浸渣”的主要成分为____。
,“浸渣”的主要成分为____。
![]() “调节pH除杂”时,需将pH调至
“调节pH除杂”时,需将pH调至![]() ,则除去的杂质离子是______,此时溶液中的
,则除去的杂质离子是______,此时溶液中的![]() ______
______![]() 已知
已知![]() 。
。
![]() “沉镁”过程中反应的离子方程式为______。
“沉镁”过程中反应的离子方程式为______。
“沉镁”时若温度超过![]() ,将产生较多的碱式碳酸镁杂质,原因是______
,将产生较多的碱式碳酸镁杂质,原因是______
![]() 流程中可以循环利用的物质是______
流程中可以循环利用的物质是______![]() 填化学式
填化学式![]() 。
。
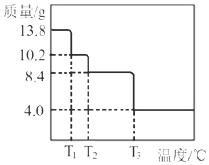
![]() 某小组同学称取
某小组同学称取![]()
![]() 进行热重分析,并绘制剩余固体质量随温度化的曲线如图所示,则
进行热重分析,并绘制剩余固体质量随温度化的曲线如图所示,则![]() ______。
______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A.0.1 mol·L-1FeCl3溶液:Mg2+、Al3+、MnO4-、SCN-
B.能使紫色石蕊试液变蓝的溶液:Ca2+、Na+、ClO-、I-
C.0.1 mol·L-1 NH4HCO3溶液:Ba2+、K+、OH-、NO3—
D.![]() =10-12的溶液:NH4+、Na+、SO42-、Cl-
=10-12的溶液:NH4+、Na+、SO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,CH3COOH和NH3.H2O的电离常数均为1.8×10-5mol/L。向20mL浓度均为0.1mol/LNaOH和NH3.H2O的混合液中滴加等浓度的CH3COOH溶液,所得混合液的相对导电能力与加入CH3COOH溶液的体积(V)关系如图所示。下列说法正确的是( )
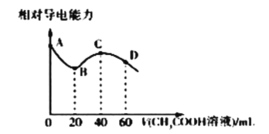
A.由A点溶液到B点溶液相对导电能力降低主要是因为离子的总物质的量减少
B.A、B、C、D四点溶液中B点溶液中水的电离程度最大
C.C点溶液呈碱性
D.D点溶液中存在: c(Na+)>c(CH3COO-)>c(NH4+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】催化技术可处理汽车尾气:![]() ,某温度下在容积不变的密闭容器中通入NO和CO,不同时间NO和CO的浓度如下表.下列说法中不正确的是
,某温度下在容积不变的密闭容器中通入NO和CO,不同时间NO和CO的浓度如下表.下列说法中不正确的是
时间 | 0 | 1 | 2 | 3 | 4 | 5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A.2s内的平均反应速率![]()
![]()
B.在该温度下![]()
C.若将容积缩小为原来的一半,NO转化率大于![]()
D.某时刻再充入![]() molNO,
molNO,![]() molCO,重新达平衡后CO浓度比原平衡大
molCO,重新达平衡后CO浓度比原平衡大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下:
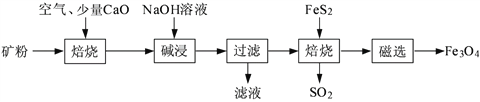
(1)焙烧过程均会产生SO2,用NaOH溶液吸收过量SO2的离子方程式为______________________。
(2)添加1%CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如题16图所示。
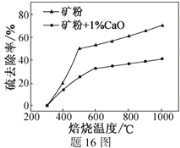
已知:多数金属硫酸盐的分解温度都高于600 ℃
硫去除率=(1—![]() )×100%
)×100%
①不添加CaO的矿粉在低于500 ℃焙烧时,去除的硫元素主要来源于__________________。
②700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是______________________________________________________。
(3)向“过滤”得到的滤液中通入过量CO2,铝元素存在的形式由_______________(填化学式)转化为_______________(填化学式)。
(4)“过滤”得到的滤渣中含大量的Fe2O3。Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2)∶n(Fe2O3)=__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 纯碱可用于去油污:CO32-+2H2O![]() 2OH-+H2CO3
2OH-+H2CO3
B. 醋酸去水垢:2H++CaCO3=Ca2++CO2↑+H2O
C. 工业制漂白粉:Cl2+2OH-=Cl-+ClO-+H2O
D. 实验室制备氢氧化铝:A13++3NH3·H2O=Al(OH)3↓+3NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列物质在水溶液中的电离方程式。
①CH3COOH _________ ② NaHSO4 __________________
(2)某温度下,纯水中的c(H+)=2×10-7 mol/L,则此时c(OH-)=______。若温度不变,滴入稀硫酸使c(H+)=5×10-6 mol/L,则由水电离出的c(H+)为_______ 。
(3)常温下,浓度均为0.01 mol/L 的两瓶溶液盐酸和氢氟酸,升高相同的温度,c(Cl-)/ c(F-)的值__________(填“变大”“变小”“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com