
在由水电离产生的H+浓度为1×10-13mol/L的溶液中,一定能大量共存的离子组是
① K+、Cl-、NO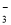 、S2- ②K+、Fe2+、I-、SO
、S2- ②K+、Fe2+、I-、SO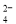 ③ Na+、Cl-、NO
③ Na+、Cl-、NO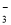 、SO
、SO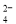
④Na+、Ca2+、Cl-、HCO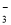 ⑤ K+、Ba2+、Cl-、NO
⑤ K+、Ba2+、Cl-、NO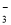
A.①③ B.③⑤ C.③④ D.②⑤
科目:高中化学 来源:2014-2015学年浙江省东阳外国语学校高二上学期期中化学试卷(解析版) 题型:选择题
某学生做中和滴定实验的过程如下:
a.取一支碱式滴定管;
b.用蒸馏水洗净;
c.加入待测 NaOH溶液;
d.记录液面刻度读数;
e.用酸式滴定管精确放出一定量标准酸液;
f.置于未经标准酸液润洗的洁净锥形瓶中;
g.加入适量蒸馏水;
h.加入酚酞试液2滴;
i.滴定时,边滴边摇动;
j.边注视滴定管内液面的变化;
k.当刚滴到溶液由无色变成粉红色时,即停止滴定;
l.记录液面读数;
m.根据滴定管的两次得出NaOH溶液的体积为22mL。
上述实验过程中的错误之处有:
A.f.g.k.m B.c.j.k.m C.c.h.i.k D.f.g.h.j.
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南鄢陵县第一高中高二上第一次考试化学(B)试卷(解析版) 题型:填空题
(13分)工业上可利用煤的气化产物(CO和H2)合成二甲醚(CH3OCH3)同时生成二氧化碳,其三步反应如下:
① 2H2 (g)+CO(g)  CH3OH (g) ΔH= -90.8 kJ·mol-1
CH3OH (g) ΔH= -90.8 kJ·mol-1
② 2CH3OH(g)  CH3OCH3(g)+H2O(g) ΔH= -23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH= -23.5 kJ·mol-1
③ CO(g)+H2O(g)  CO2 (g)+H2(g) ΔH= -41.3 kJ·mol-1
CO2 (g)+H2(g) ΔH= -41.3 kJ·mol-1
(1)总合成反应的热化学方程式为 。
(2)一定条件下的密闭容器中,上述总反应达到平衡时,要提高CO的转化率,可以采取的措施是_____(填字母代号)。
A 高温高压 B 加入催化剂 C 减少CO2的浓度
D.增加CO的浓度 E.分离出二甲醚
(3)反应②2CH3OH(g) CH3OCH3(g)+H2O(g)在四种不同条件下进行(反应器均为相同的恒容密闭容器,CH3OCH3、H2O起始浓度为0),CH3OH(g)的浓度(mol/L)随反应时间(min)的变化情况如下表:
CH3OCH3(g)+H2O(g)在四种不同条件下进行(反应器均为相同的恒容密闭容器,CH3OCH3、H2O起始浓度为0),CH3OH(g)的浓度(mol/L)随反应时间(min)的变化情况如下表:
实验 序号 | 温度 浓度 时间 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,完成下列填空:
①实验1,反应在10至20分钟时间内用CH3OH(g)表示的平均速率为 。
②实验2,CH3OH(g)的初始浓度c2= mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。
③设实验3的反应速率为v3,实验1的反应速率为v1,则v3 v1(填>、=、<),且c3= mol/L。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南鄢陵县第一高中高二上第一次考试化学(B)试卷(解析版) 题型:选择题
已知H2(g)+Br2(l)=2HBr(g) ΔH=-72kJ·mol-1,蒸发1mol 液溴变Br2(g)需要吸收的能量为30kJ,其它相关数据如下表:
| H2(g) | Br2(g) | HBr(g) |
1mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | a | 369 |
则表中a为
A.404 B.260 C.230 D.200
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南鄢陵县第一高中高二上第一次考试化学(A)试卷(解析版) 题型:填空题
(11分)(1)已知:①Fe(s)+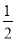 O2(g)=FeO(s) ΔH1=-272.0 kJ·mol-1;
O2(g)=FeO(s) ΔH1=-272.0 kJ·mol-1;
②2Al(s)+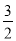 O2(g)===Al2O3(s) ΔH2=-1675.7 kJ·mol-1。
O2(g)===Al2O3(s) ΔH2=-1675.7 kJ·mol-1。
Al和FeO发生铝热反应的热化学方程式是 。
某同学认为,铝热反应可用于工业炼铁,你的判断是 (填“能”或“不能”),
你的理由是 。
(2)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,
如图所示。
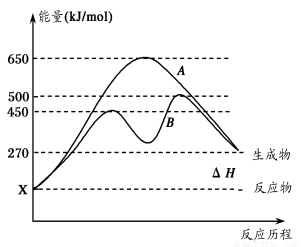
①据图判断该反应是___(填“吸”或“放”)热反应,当反应达到平衡后,其他
条件不变,升高温度,逆反应速率将____(填“增大”、“减小”或“不变”)。
②其中B历程表明此反应采用的条件为________(填字母)。
A.升高温度 B.增大反应物的浓度
C.降低温度 D.使用催化剂
(3)已知热化学方程式:H2(g)+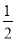 O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南鄢陵县第一高中高二上第一次考试化学(A)试卷(解析版) 题型:选择题
一定温度下在一容积不变的密闭容器中发生可逆反应2X(g) Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是
Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是
A.2v正(X)=v逆(Y) B.单位时间内生成1 mol Y的同时生成2 mol X
C.混合气体的密度不再变化 D.反应容器中Y的质量分数不变
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南鄢陵县第一高中高一上第一次考试化学(B)试卷(解析版) 题型:计算题
(10分)10gCO和CO2的混合气体在标准状况下的体积是6.72L,则混合气体中CO的体积是多少升? CO2的质量是多少克?
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南鄢陵县第一高中高一上第一次考试化学(B)试卷(解析版) 题型:选择题
下列实验操作正确的是( )
A.硫酸钠中含有少量碳酸钠,加入盐酸除去碳酸钠杂质
B.萃取时,将酒精和碘化钾溶液放入分液漏斗中静置分层
C.用分液漏斗分离互不相容的两种液体时,先放出下层液体,然后再放出上层液体
D.配制一定物质的量浓度溶液定容时,用胶头滴管滴加蒸馏水至溶液凹液面最低点与刻度线相切
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高一上第二次考试化学试卷(解析版) 题型:填空题
(每空2分,共10分)用于分离或提纯物质的方法有:A蒸馏(分馏) B萃取 C.过滤 D.重结晶 E.分液。下列各组混合物的分离或提纯应选用上述哪一种方法最合适?(填方法的标号.)
(1)分离四氯化碳与水的混合物
(2)分离汽油和煤油
(3)除去Ca(OH)2溶液中悬浮的CaCO3微粒
(4)分离碘水中的碘单质
(5)分离提纯氯化钠和硝酸钾混合物中的硝酸钾
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com