
| A. | pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)═c(OH-)+c(A-) | |
| B. | 1 L 0.1 mol•L-1 (NH4)2Fe(SO4)2的溶液中:c(SO${\;}_{4}^{2-}$)>c(NH${\;}_{4}^{+}$)>c(Fe2+)>c(H+)>c(OH-) | |
| C. | 0.1 mol•L-1 NaHCO3溶液中:c(H+)+c(H2CO3)═c(CO${\;}_{3}^{2-}$)+c(OH-) | |
| D. | 0.1mol•L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
分析 A.根据溶液的电荷守恒进行判断;
B.硫酸根离子不水解,而铵根离子水解,铵根离子与亚铁离子水解溶液呈酸性;
C.根据质子守恒进行判断;
D.0.1 mol/L的NaHA溶液,其pH=4,说明HA-电离程度大于水解程度.
解答 解:A.pH=2的HA溶液与pH=12的MOH溶液以任意比混合,溶液都不显电性,由电荷守恒可知,c(H+)+c(M+)=c(OH-)+c(A-),故A正确;
B.硫酸根离子不水解,而铵根离子水解,铵根离子与亚铁离子水解溶液呈酸性,所以离子浓度的大小为:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-),故B正确;
C.0.1 mol•L-1 NaHCO3溶液中,根据质子守恒可知:c(H+)+c(H2CO3)═c(CO32-)+c(OH-),故C正确;
D.pH=4,则HA-的电离大于其水解,电离生成A2-,则c(HA-)>c(H+)>c(A2-)>c(H2A),故D错误.
故选D.
点评 本题考查离子浓度大小的比较,明确盐类水解、电离、浓度与pH 的关系及物料守恒、电荷守恒即可解答,难度较大.


科目:高中化学 来源: 题型:推断题
| 元素 | 相 关 信 息 |
| A | 原子核外有7种运动状态不同的电子 |
| B | 外围电子排布式为nsnnpn+2 |
| C | 常见的金属,在周期表中周期序数与族序数相等 |
| D | 气态氢化物及最高价氧化物对应的水化物均为强酸 |
| E | 一种核素的质量数为56,中子数为30 |
| F | 单质紫红色,电缆材料,常见氧化物为黑色 |
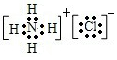
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 分子式 | 结构简式 | 外观 | 熔点 | 溶解性 |
| C12H10ClN3O | 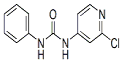 | 白色结晶粉末 | 170~172°C | 易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
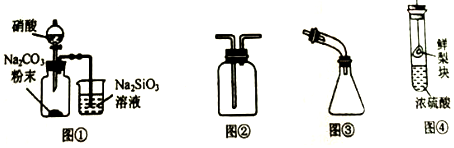
| A. | 图①:证明非金属性由强到弱的顺序是N>C>Si | |
| B. | 图②:收集NO2或NH3 | |
| C. | 图③:海水蒸馏时接收蒸馏水 | |
| D. | 图④:探究浓硫酸的脱水性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
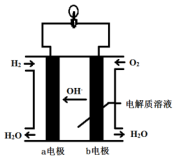 英国一家公司正在研发全球首款“充一次电,用七天”的碱性氢氧燃料手机电池.如图为碱性氢氧燃料电池结构示意图.
英国一家公司正在研发全球首款“充一次电,用七天”的碱性氢氧燃料手机电池.如图为碱性氢氧燃料电池结构示意图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它与足量的水反应的化学方程式为:NH5+H2O═NH3•H2O+H2↑ | |
| B. | NH5中只有极性共价键的共价化合物 | |
| C. | 1molNH5中含有5NA个N-H键(NA表示阿伏伽德罗常数) | |
| D. | NH5中所有原子最外层均为8个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
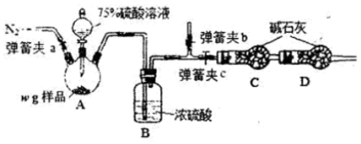

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 (1)溶液的pH除了可以通过实验得出的具体数据计算得到,在实验室中还可以用pH试纸或pH计来测量得到.
(1)溶液的pH除了可以通过实验得出的具体数据计算得到,在实验室中还可以用pH试纸或pH计来测量得到.| 滴定次数 | 待测液体积(mL)[来源 | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com