
【题目】)硫酸钙来源于烟气脱硫、磷酸盐工业和其他工业的副产品,可用于生成硫酸及其硫化物等。硫酸钙在高温下被CO还原,发生的反应有:
I.CaSO4(s)+4CO(g) ![]() CaS(s)+4CO2(g) △Hl 平衡常数K1
CaS(s)+4CO2(g) △Hl 平衡常数K1
II.CaSO4(s)+CO(g) ![]() CaO(s)+SO2(g)+CO2(g) △H2 平衡常数K2
CaO(s)+SO2(g)+CO2(g) △H2 平衡常数K2
III.3CaSO4(s)+CaS(s) ![]() 4CaO(s)+4SO2(g) △H3=+1049.2kJ/mol 平衡常数K3
4CaO(s)+4SO2(g) △H3=+1049.2kJ/mol 平衡常数K3
(1)△H3=___(用△H1、△H2表示);平衡常数K3=_______(用K1、K2表示)。
(2)上述反应的平衡常数的对数值(lgK)与温度(T)的关系如下图所示:
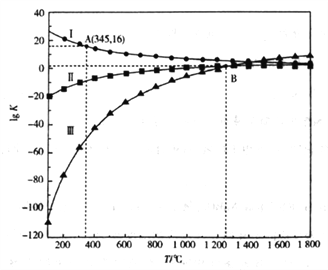
①△H1_________0(填”>”或”<")。
②若只发生反应I,A点c(CO)/c(CO2)=__________(填数值)。
③若只发生反应II和III,B点c(CO)、c(CO2)及c(SO2)之间的关系是__________。
【答案】 4△H2-△H1 ![]() < 1×10-4 c(CO2)=c(CO)·c3(SO2)
< 1×10-4 c(CO2)=c(CO)·c3(SO2)
【解析】试题分析:(1)根据盖斯定律计算△H3;根据K1、K2、K3的表达式分析;(2)根据图像可知升高温度lgK减小,说明升高温度K减小,即平衡逆向移动;②若只发生反应I的平衡常数K=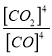 ,A点
,A点![]() ;
; ![]() 、
、![]() , 根据图像可知B点
, 根据图像可知B点![]() 。
。
解析:(1)I.CaSO4(s)+4CO(g) ![]() CaS(s)+4CO2(g) △Hl
CaS(s)+4CO2(g) △Hl
II.CaSO4(s)+CO(g) ![]() CaO(s)+SO2(g)+CO2(g) △H2,根据盖斯定律II ×4-I得3CaSO4(s)+CaS(s)
CaO(s)+SO2(g)+CO2(g) △H2,根据盖斯定律II ×4-I得3CaSO4(s)+CaS(s) ![]() 4CaO(s)+4SO2(g) △H3=4△H2-△H1; K1=
4CaO(s)+4SO2(g) △H3=4△H2-△H1; K1=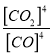 、
、![]() 、
、![]() ,平衡常数K3=
,平衡常数K3=![]() ;(2)根据图像可知升高温度lgK减小,说明升高温度K减小,即平衡逆向移动,所以正反应放热△H1<0;②若只发生反应I的平衡常数K=
;(2)根据图像可知升高温度lgK减小,说明升高温度K减小,即平衡逆向移动,所以正反应放热△H1<0;②若只发生反应I的平衡常数K= ,A点
,A点![]() ,即
,即 =
=![]() ,c(CO)/c(CO2)= 1×10-4;
,c(CO)/c(CO2)= 1×10-4; ![]() 、
、![]() , 根据图像
, 根据图像![]() ,所以
,所以![]() ,c(CO2)=c(CO)·c3(SO2)。
,c(CO2)=c(CO)·c3(SO2)。


科目:高中化学 来源: 题型:
【题目】下列物质的化学式和名称不相符的是( )。
A.(NH4)2SO4 硫酸铵
B.CO(NH2)2 尿素
C.KH2PO4 (磷酸二氢钾)
D.Ca(H2PO4)2 过磷酸钙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2HI(g)![]() H2(g)+I2(g)的能量变化如图所示。下列说法正确的是
H2(g)+I2(g)的能量变化如图所示。下列说法正确的是

A. 0.2molHI充分分解,吸收1.25kJ热量
B. 加入催化剂,Ea减小,△H不变
C. 其他条件不变,升高温度,反应速率加快,HI分解率不变
D. 其他条件不变,增大压强,反应速率加快,HI分解率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十九大报告中指出:“建设美丽中国,为人民创造良好生产生活环境,为全球生态安全作出贡献。”下列行为一般不会引起环境污染的是
A.冬季燃煤供暖B.废电池深埋降解
C.利用风能、太阳能发电D.节日燃放烟花爆竹
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是( )
A. 用长颈漏斗分离出乙酸与乙醇反应的产物
B. 用向上排空气法收集铜粉与稀硝酸反应产生的![]()
C. 配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释
D. 将![]() 与
与![]() 混合气体通过饱和食盐水可得到纯净的
混合气体通过饱和食盐水可得到纯净的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石主要成分是Cu2(OH)2CO3,还含少量FeCO3及Si的化合物,实验室以孔雀石为原料制备硫酸铜晶体的步骤如下:
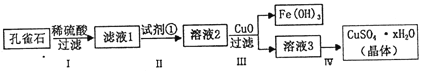
(1)步骤I中涉及的主要反应用离子方程式表示为___________.
(2)步骤Ⅱ中试剂①是_______(填代号).
a.KMnO4 b.H2O2 c.Fe粉 d.KSCN
(3)步骤Ⅲ加入CuO 的目的是_________
(4)步骤Ⅳ获得硫酸铜晶体,需要经过_____________冷却结晶、过滤等操作.
(5)测定硫酸铜晶体(CuSO4·xH2O)中结晶水的x值:称取2.41g硫酸铜晶体,在____(填实验仪器名称)中加热至质量不再改变时,称量粉末的质量为1.6g.则计算得x=______(计算结果精确到0.1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ksp(CaSO4)= 9×10-4,常温下CaSO4在水中的沉淀溶解平衡曲线如图所示。下列判断中正确的是

A. a点对应的溶液中c(H+)·c(OH-) 的数值为1×10-14
B. a 点对应的Ksp不等于c点对应的Ksp
C. b 点将有沉淀生成,平衡后溶液中c(SO42-)= 3×10-3mol/L,而向d 点溶液中加入适量的CaSO4固体可以变到c 点
D. CaSO4的饱和溶液中c(SO42-) > c(Ca2+) >c(H+) >c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com