
| 1 |
| 2 |


科目:高中化学 来源: 题型:
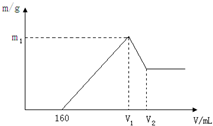 将镁铝的混合物0.1mol溶于100mL 2mol?L-1硫酸溶液中,然后再滴加1mol?L-1氢氧化钠溶液,请回答以下问题:
将镁铝的混合物0.1mol溶于100mL 2mol?L-1硫酸溶液中,然后再滴加1mol?L-1氢氧化钠溶液,请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 (不考虑立体结构,其中R为
(不考虑立体结构,其中R为 ).M的一条合成路线如下(部分反应试剂和条件省略).
).M的一条合成路线如下(部分反应试剂和条件省略).
| 反应试剂 |
| 反应条件 |
| 反应试剂 |
| 反应条件 |
 与
与 的化学性质相似.
的化学性质相似.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 核外电子排布的特点 | 元 素 符 号 |
| (1)最外层电子数为2的原子 | |
| (2)次外层电子数是最外层电子数2倍的原子 | |
| (3)最外层电子数是次外层电子数3倍的原子 | |
| (4)原子核内无中子的原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
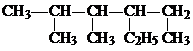 的名称是
的名称是 化合物A中含氧官能团的名称
化合物A中含氧官能团的名称查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com