
【题目】下列有关物质性质与用途具有对应关系正确的是
A. 氯化钠溶液显中性,可用铝制容器贮存氯化钠溶液
B. 氢氧化镁分解时吸收大量的热量,添加到合成树脂中可作阻燃剂
C. 碳酸钠溶液具有碱性,可用于治疗胃酸过多
D. 氯化铁溶液呈酸性,可用于蚀刻铜电路板
【答案】B
【解析】
A. 氯化钠溶液与铝制容器可以构成原电池,金属铝作负极,发生电化学腐蚀,加快铝腐蚀,故A错误;
B. 阻燃物质原理有三个:清除可燃物、隔绝氧气或空气、使可燃物的温度降到着火点以下,三者具其一即可,氢氧化镁在380℃时分解,方程式为:Mg(OH)2![]() MgO+H2O↑,氢氧化镁分解过程中吸收大量的热,能使可燃物的温度降到着火点以下,反应生成的水蒸气能稀释可燃物表面的氧气,生成氧化镁固体能隔绝氧气或空气,故B正确;
MgO+H2O↑,氢氧化镁分解过程中吸收大量的热,能使可燃物的温度降到着火点以下,反应生成的水蒸气能稀释可燃物表面的氧气,生成氧化镁固体能隔绝氧气或空气,故B正确;
C. 纯碱溶液碱性太强,不能用于治疗胃酸分泌过多,应选用碳酸氢钠,故C错误;
D. 氯化铁溶液可用于蚀刻铜电路板,是由于Fe3+能与Cu发生氧化还原反应,利用了Fe3+的强氧化性,故D错误。
故选B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】可用如侧示意图象表示的是
反应 | 纵坐标 | 甲 | 乙 |
| |
A | 等质量的钾、钠分别与水反应 | H2的质量 | 钠 | 钾 | |
B | 相同质量的氨气在同一恒容容器发生2NH3 | NH3的转化率 | 500 | 400 | |
C | 体积比为1:3的N2、H2在体积可变的恒压容器中发生2NH3 | NH3的浓度 | 活性高的催化剂 | 活性一般的催化剂 | |
D | 2molSO2与1molO2在同温下发生2SO2+O2 | SO3物质的量 | 2个大气压 | 10个大气压 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G(二乙酰氨乙酸乙二胺)是可预防和治疗各种原因出血的药物。某化学小组查阅资料后,设计合成路线如下:

回答下列问题:
(1)A的化学名称为__________________,G的分子式为_______________________。
(2)②的反应类型为____________________________。
(3)⑥的化学方程式为__________________________________。
(4)H是E的同分异物体,H中所有原子均以共价单键相连(结构中可存在“—O—O—”),H的可能结构有_______种,其中核磁共振氢谱只有一组峰的结构简式为___________(任写一种)。
(5)设计由A、B为起始原料制备聚乙二酸乙二胺的合成路线______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国最近在太阳能光电催化-化学耦合分解硫化氢研究中获得新进展,相关装置如图所示。下列说法正确的是

A.该装置工作时,H+由b极区流向a极区
B.该制氢工艺中光能最终转化为化学能
C.a极上发生的电极反应为Fe3++e-=Fe2+
D.a极区需不断补充含Fe3+和Fe2+的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向50 mL溶有0.1molCl2的氯水中滴加2mol/L的NaOH溶液,得到溶液pH随所加NaOH溶液体积的变化图像如下图所示。下列说法正确的是

A. 若a点pH=4,且c(Cl-)=m·c(ClO-),则Ka(HClO)=![]()
B. 若x=100,b点对应溶液中:c(OH-)>c(H+),可用pH试纸测定其pH
C. b~c段,随NaOH溶液的滴入,![]() 逐渐增大
逐渐增大
D. 若y=200,c点对应溶液中:c(OH-)-c(H+)=2c(Cl-)+c(HClO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用如图所示装量制取少量澳苯并证明该反应是取代反应。请回答:

(1)仪器A的名称为____________,冷凝水的进水口为_________,(填“m”或“n”)。
(2)制取溴苯的化学方程式为___________________。
(3)锥形瓶中足量NaOH溶液的作用是_________。
(4)从实验安全的角度分析,该实验装置存在一处明显的缺陷请指出_________。
(5)反应结束后向三颈瓶中滴加氢氧化钠溶液,充分振荡,然后用__________(填仪器名称)分离出溴苯(仍含有少量苯)。
(6)设计实验证明制取溴苯的反应是取代反应___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. MgCO3![]() MgCl2(aq)
MgCl2(aq)![]() Mg
Mg
B. H2SO4(浓)![]() SO2
SO2![]() BaSO3(s)
BaSO3(s)
C. NaAlO2![]() AlCl3(aq)
AlCl3(aq)![]() AlCl3(s)
AlCl3(s)
D. NaCl(aq)![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用0.1000 mol·L1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,反应离子方程式是:2MnO4+5H2C2O4+6H+![]() 2Mn2++10CO2↑+8H2O。填空完成问题:
2Mn2++10CO2↑+8H2O。填空完成问题:
(1)该滴定实验必需的玻璃仪器有______________。(填字母)
A.酸式滴定管 B.碱式滴定管 C.量筒 D.锥形瓶
E.铁架台 F.滴定管夹 G.白纸 H.漏斗
(2)不用________(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液。试分析原因___________________。
(3)滴定终点的现象为_________________________________________________________。
(4)若滴定开始和结束时,滴定管中的液面如图所示,则起始读数为____mL,终点读数为_____mL。

(5)某学生根据3次实验分别记录有关数据如下表:
滴定次数 | 待测H2C2O4溶液的体积/mL | 0.1000 mol/L KMnO4的体积(mL) | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据列式计算该H2C2O4溶液的物质的量浓度为_______________。
(6)下列操作中可能使测定结果偏低的是___________(填字母)。
A.酸式滴定管未用标准液润洗就直接注入KMnO4标准液
B.滴定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定后有气泡
D.读取KMnO4标准液时,开始仰视读数,滴定结束时俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气及许多含氯化合物是生产、生活中应用非常广泛的物质。磺酰氯(SO2Cl2)是实验室中常见试剂。已知:SO2Cl2(g)![]() SO2(g)+Cl2(g)
SO2(g)+Cl2(g)
(1)在2 L恒容密闭耐腐蚀性的容器中充入0.1 mol SO2Cl2(g)发生反应,在101 kPa、375K条件下进行该反应,SO2Cl2的转化率与时间关系如图所示。
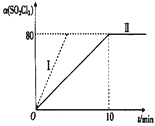
①平衡时,容器内压强p=_________________。
②相对曲线Ⅱ对应实验,仅改变一个条件得到曲线I,曲线I改变的条件可能是_____________________。
(2)一定量氯气用饱和纯碱溶液吸收恰好只生成三种盐(不产生气体),该溶液中阴离子浓度大小顺序为______________________________________________________。
(3)已知:常温下,次氯酸(HClO)的电离常数Ka=2.5×10-8,则在该温度下,NaClO水解反应的水解常数Kh为______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com