
SiO2、SO2和CO2都是酸性氧化物,它们的化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性。某兴趣小组用如图所示装置进行Mg与SO2反应的实验。

(1)选择制取SO2的合适试剂 (填编号)。
①浓HCl ②浓H2SO4 ③Na2SO3固体 ④CaSO3固体
(2)上述装置还可优化,优化的方法是 ,装置C中NaOH溶液的作用是 。
(3)甲同学推测Mg与SO2的反应与CO2相似,则该反应方程式为
;乙同学的推测是:2Mg+3SO2 2MgSO3+S;丙同学的推测是:3Mg+SO2
2MgSO3+S;丙同学的推测是:3Mg+SO2 2MgO+MgS,要验证甲、乙、丙三位同学的推测是否正确,丁同学作如下实验探究:
2MgO+MgS,要验证甲、乙、丙三位同学的推测是否正确,丁同学作如下实验探究:
已知:MgSO3和MgS都是微溶于水,能与盐酸发生复分解反应放出气体;H2S气体通入CuSO4溶液中出现黑色沉淀。
限选试剂:2mol/L HCl、2mol/L HNO3、蒸馏水、2mol/L NaOH、品红溶液、澄清石灰水、2mol/L CuSO4;仪器和用品自选。
|
序号 |
实验步骤 |
预期现象和结论 |
|
① |
取少量反应后所得固体于试管中 |
|
|
② |
向试管中的固体慢慢滴加 , 试管口塞上带导管的单孔塞,并将导管通入盛有 的试管中。 |
若试管中的 , 则丙同学推测正确。 若试管中的固体未完全溶解,且 ,则乙同学推测正确。 |
根据上述实验探究,能证明甲同学推测正确的操作和预期现象是 。
(4)上述实验需要100mL,2mol/L的HCl,配制时选用 (选填10 mL、25 mL、50 mL或100 mL)量筒量取36.5%,密度1.19g/mL的浓盐酸的体积为 mL。(保留三位有效数字)
(16分)
(1)②③(2分)(有错不给分)
(2)在A和B之间增加用浓硫酸干燥的装置(2分);(或在B管药品下垫钢片也给2分)
(若有BC之间加用浓硫酸干燥的装置不算给分或扣分点,没有说明AB之间得0分)
吸收多余的SO2,防止污染环境(1分)
(只写其中一个就给1分,有错不给分)
(3)2Mg+SO2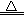 2MgO+S(2分)
2MgO+S(2分)
(没写条件扣1分,条件可以写点燃,没有配平扣1分)
方案I
|
② |
2mol/L 盐酸至过量(1分); (盐酸没写浓度、没有写过量或足量不给分)
品红(1分)(或品红溶液) |
固体完全溶解;(1分) (没有写完全不给分) (另加品红不褪色不算得分点) 品红溶液褪色(1分);(若只写品红也给分) |
方案II
|
② |
2mol/L 盐酸至过量(1分); 1~2ml(体积不算给分点)2mol/L CuSO4(1分) |
出现黑色沉淀;(1分)(没有写黑色不给分) 有刺激性气味的气体产生(1分); |
向反应后所得固体加过量2mol/L盐酸(写2mol/L硝酸不扣分)(给1分),固体未完全溶解且品红溶液不褪色(两个现象都对才给1分)(或反应后固体未完全溶解于盐酸且无气体产生(两个现象都对才给1分))(2分)
或者向反应后所得固体加过量2mol/LHCl(1分),固体未完全溶解且盛有2mol/L CuSO4的试管没有出现明显变化。(1分)前后答案不牵制,各得各的分
(4)25mL(1分)(有错不给分);16.8(16.7~17.0 都给2分,若只写17扣1分) (2分)
【解析】
试题分析:(1)亚硫酸的酸性比硫酸弱,根据强制弱的复分解反应原理,Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,因此应选择浓硫酸和亚硫酸钠制取二氧化硫气体,不能选择亚硫酸钙,因为亚硫酸钙、硫酸钙都微溶于水;也不能选择浓盐酸,因为盐酸具有挥发性,产生的HCl、水蒸气对镁与二氧化硫的反应产物产生干扰;(2)上述装置缺少干燥装置,应在在A和B之间增加用浓硫酸干燥的装置;二氧化硫具有酸性氧化物的通性,容易与氢氧化钠溶液反应生成亚硫酸钠和水,从而吸收多余的二氧化硫、防止污染环境;(3)由于CO2(g)+4Na(g)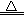 2Na2O(s)+C(s,金刚石),则CO2+2Mg
2Na2O(s)+C(s,金刚石),则CO2+2Mg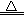 2MgO+C,由此类比或仿写,则2Mg+SO2
2MgO+C,由此类比或仿写,则2Mg+SO2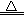 2MgO+S;装置B中固体产物可能是MgO和S或MgSO3和S或MgO和MgS,根据物质性质及已知信息可知,单质硫是难溶于水的黄色固体,也不溶于盐酸或稀硝酸;氧化镁难溶于水,可溶于盐酸或硝酸;亚硫酸镁微溶于水,易溶于盐酸或硝酸,但前者反应产生二氧化硫气体,二氧化硫气体可用品红溶液检验,后者没有二氧化硫产生,而是产生一氧化氮;硫化镁微溶于水,易溶于盐酸或硝酸,前者反应生成硫化氢气体,硫化氢通入硫酸铜溶液产生黑色沉淀,后者不产生硫化氢,而是产生单质硫和一氧化氮气体;根据上述性质可以确定检验试剂,以及预期现象和结论,从而设计合理的实验方案;(4)先根据c•V=n求稀盐酸中溶质的物质的量,再根据n•M=m求稀溶液中溶质的质量,由于稀释前后溶质质量保持不变,然后根据溶质质量除质量分数可求浓盐酸的质量,最后根据浓溶液质量除以密度求浓盐酸的体积,即浓盐酸体积计算表达式=
2MgO+S;装置B中固体产物可能是MgO和S或MgSO3和S或MgO和MgS,根据物质性质及已知信息可知,单质硫是难溶于水的黄色固体,也不溶于盐酸或稀硝酸;氧化镁难溶于水,可溶于盐酸或硝酸;亚硫酸镁微溶于水,易溶于盐酸或硝酸,但前者反应产生二氧化硫气体,二氧化硫气体可用品红溶液检验,后者没有二氧化硫产生,而是产生一氧化氮;硫化镁微溶于水,易溶于盐酸或硝酸,前者反应生成硫化氢气体,硫化氢通入硫酸铜溶液产生黑色沉淀,后者不产生硫化氢,而是产生单质硫和一氧化氮气体;根据上述性质可以确定检验试剂,以及预期现象和结论,从而设计合理的实验方案;(4)先根据c•V=n求稀盐酸中溶质的物质的量,再根据n•M=m求稀溶液中溶质的质量,由于稀释前后溶质质量保持不变,然后根据溶质质量除质量分数可求浓盐酸的质量,最后根据浓溶液质量除以密度求浓盐酸的体积,即浓盐酸体积计算表达式= =16.8mL;根据量筒的使用方法,25mL规格量筒最接近16.8mL,因此应选择25mL规格。
=16.8mL;根据量筒的使用方法,25mL规格量筒最接近16.8mL,因此应选择25mL规格。
考点:考查化学实验方案的设计与评价,涉及二氧化硫气体制取方法、气体制法、性质、尾气处理装置的评价和改进、元素化合物的重要性质、物质成分探究实验方案的设计、稀释定律、物质的量浓度、物质的量、溶液密度、溶液体积、质量分数等量的计算等。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2012-2013学年湖北省高三秋季期中联考化学试卷(解析版) 题型:选择题
t℃时,在两个相同的密闭刚性容器(等容)中分别进行SO2和SO3相互转化的实验,反应的化学方程式为2SO2(g)+O2(g) 2SO3(g),实验Ⅰ和实验Ⅱ情况分别为图Ⅰ和图Ⅱ所示:
2SO3(g),实验Ⅰ和实验Ⅱ情况分别为图Ⅰ和图Ⅱ所示:
数据分析发现:达到平衡时,化学状态Ⅰ和化学状态Ⅱ完全相同。下列叙述不正确的是
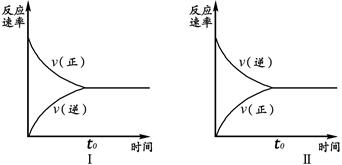
A.若实验ⅠSO2的起始浓度为1mol/L,则实验ⅠO2的起始浓度为0.5mol/L;实验ⅡSO3的起始浓度为1mol/L.
B.若实验ⅠSO2的转化率为a%,则实验ⅡSO3 的转化率为1-a%。
C.若起始浓度C(SO2) m mol/L,C(O2)=" n" mol/L,C(SO3)=" p" mol/L,在相同条件下进行实验,要求达到平衡时的状态与实验Ⅰ、Ⅱ完全相同,则m、n、p必须满足的条件是m/n="2" 和 m+p=1。
D.维持实验Ⅰ的起始浓度和实验温度不变,改密闭刚性容器为密闭可变体积容器(等压容器)进行实验,达到化学平衡时:SO2的转化率与实验Ⅰ中SO2的转化率相比要小,但正反应速率与实验Ⅱ相比要大。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东济宁汶上一中高三12月月考化学试卷 题型:选择题
下列各组物质中,不能按 (“一”表示一步完成)关系相互转化的是 ( )
(“一”表示一步完成)关系相互转化的是 ( )
|
|
a |
b |
c |
|
A |
H2O |
O2 |
Fe(OH)3 |
|
B |
CO2 |
C |
CO |
|
C |
H2SO4 |
C |
NO2 |
|
D |
Si |
SiO2 |
H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质中,不能按(“一”表示一步完成)关系相互转化的是 ( )
|
| a | b | c |
| A | H2O | O2 | Fe(OH)3 |
| B | CO2 | C | CO |
| C | H2SO4 | C | NO2 |
| D | Si | SiO2 | H2SiO3 |
查看答案和解析>>
科目:高中化学 来源:2012届江苏省盐城市田家炳中学高三上学期期中考化学试卷(带解析) 题型:单选题
下列说法正确的是
| A.工业用SiO2与焦炭制取单质硅过程中,生成的气体产物是CO |
| B.硫在空气中燃烧的产物是SO2,在纯净氧气中燃烧的产物是SO3 |
| C.钠在敞口容器中长期存放和在空气中燃烧的产物都是Na2O2 |
| D.镁在空气中和纯净氧气中燃烧的产物都只有MgO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com