
| A. | 放电时,负极发生反应的物质是Li1-xCoO2 | |
| B. | 充电时,阴极发生氧化反应 | |
| C. | 放电时,Li+由负极向正极迁移 | |
| D. | 充电时,阳极的电极反应式为:xLi++nC+xe-=LixCn |
分析 根据电池反应式知,负极反应式为LixCn-xe-=nC+xLi+、正极反应式为Li1-xCoO2+xLi++xe-=LiCoO2,充电时,阴极、阳极反应式与负极、正极反应式正好相反,以此解答该题.
解答 解:放电时的反应为Li1-xCoO2+LixCn=LiCoO2+nC,C元素的化合价升高,Co元素的化合价降低,
A.C元素的化合价升高,则放电时LixCn失电子,即负极发生反应的物质是LixCn,故A错误;
B.充电时阴极的反应与负极的反应相反,则阴极发生得电子的还原反应,故B错误;
C.放电时,阳离子向正极移动,则Li+由负极向正极迁移,故C正确;
D.充电时,阳极的反应与正极的反应相反,则阳极反应为:LiCoO2-xe-═Li1-xCoO2+xLi+,故D错误;
故选C.
点评 本题考查原电池原理,明确电池反应中元素的化合价变化及原电池的工作原理即可解答,注意与氧化还原反应的结合,题目难度中等,侧重于考查学生的分析能力.


科目:高中化学 来源: 题型:选择题
| A. | 将铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+═3Fe3++4H2O | |
| C. | 将氯化亚铁溶液和氯气反应:Fe2++Cl2═Fe3++2 Cl- | |
| D. | 将铜屑加入含Fe3+的溶液中:2Fe3++Cu═2Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+ | |
| B. | 强酸性溶液中:Na+、K+、NO3-、SiO32- | |
| C. | 可与Al反应放出氢气的溶液中:Na+、Ca2+、Cl-、HCO3- | |
| D. | 使石蕊变蓝的溶液中:Ba2+、Na+、AlO2-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
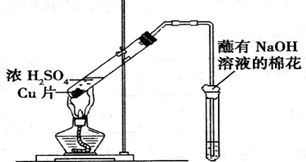
| 试管中试剂 | 试管中现象 | 解 释 | |
| A | 硝酸酸化的BaCl2溶液 | 生成白色沉淀 | 白色沉淀为BaSO3 |
| B | 品红溶液 | 溶液褪色 | SO2具有漂白性 |
| C | 紫色石蕊溶液 | 溶液变红 | SO2水溶液显酸性 |
| D | 酸性KMnO4溶液 | 紫色褪去 | SO2具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 硼化钒(VB2)、空气电池是目前储电能力最高的电池,电池示意图如图.该电池的反应产物分别是V2O5和B的最高价氧化物.下列说法正确的是( )
硼化钒(VB2)、空气电池是目前储电能力最高的电池,电池示意图如图.该电池的反应产物分别是V2O5和B的最高价氧化物.下列说法正确的是( )| A. | 图中选择性透过膜应只允许阴离子通过 | |
| B. | 电池工作过程中a电极附近溶液pH减小 | |
| C. | VB2电极发生的电极反应为:2VB2+11H2O-22e-═V2O5+2B2O3+22H+ | |
| D. | 如果负载为氯碱工业装置,外电路中转移0.1mol电子,则阴极生成气体1120mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定有Cl2 | B. | 一定有SO2 和NO | ||
| C. | 可能有NO2 | D. | 一定有SO2,可能有NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.2g | B. | 16.8g | C. | 22.4g | D. | 33.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第七周期第IIIA族 | B. | 第七周期第VA族 | ||
| C. | 第七周期第IIIB族 | D. | 第七周期第VB族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com