
【题目】合理利用或转化NO2、SO2、CO、NO等污染性气体是人们共同关注的课题。
Ⅰ.某化学课外小组查阅资料后得知:2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
①2NO(g)![]() N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) H1<0
N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) H1<0
②N2O2(g)+O2(g)![]() 2NO2(g)(慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) H2<0
2NO2(g)(慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) H2<0
请回答下列问题:

(1)反应2NO(g)+O2(g)![]() 2NO2(g)的H=________________(用含H1和H2的式子表示)。一定温度下,反应2NO(g)+O2(g)
2NO2(g)的H=________________(用含H1和H2的式子表示)。一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=_____________________。
2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=_____________________。
(2)决定2NO(g)+O2(g)![]() 2NO2(g)反应速率是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1________E2(填“>”、“<”或“=”)。
2NO2(g)反应速率是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1________E2(填“>”、“<”或“=”)。
Ⅱ.(3)反应N2O4(g)![]() 2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2)。其中k1、k2是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态的两个点是_______________,理由是__________________________________________________________________________________________。
2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2)。其中k1、k2是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态的两个点是_______________,理由是__________________________________________________________________________________________。
(4)在25℃时,将a mol·L-1的氨水溶液与0.02 mol·L-1 HCl溶液等体积混合后溶液恰好呈中性(忽略溶液混合后体积的变化),用含a的表达式表示250C时NH3·H2O的电离常数Kb=_________________。用质量分数为17%,密度为0.93 g/cm3的氨水,配制200 mL a mol·L-1的氨水溶液,所需原氨水的体积V=___________mL。
(5)如图电解装置可将雾霾中的NO、SO2分别转化为NH4+和SO42-。物质A的化学式为_________,阴极的电极反应式是__________________________。

【答案】 △H1+△H2 ![]() < BD 图中只有D点NO2的消耗速率是B点N2O4的消耗速率的2倍,所以表示达到化学平衡状态的点是BD (2×10-9 )/(a-0.02) 21.5a或200a/9.3或2000a/93 H2SO4 NO+6H++5e-=NH4++H2O
< BD 图中只有D点NO2的消耗速率是B点N2O4的消耗速率的2倍,所以表示达到化学平衡状态的点是BD (2×10-9 )/(a-0.02) 21.5a或200a/9.3或2000a/93 H2SO4 NO+6H++5e-=NH4++H2O
【解析】Ⅰ.(1)①2NO(g)N2O2(g);②N2O2(g)+O2(g)2NO2(g),而目标反应2NO(g)+O2(g)2NO2(g)的△H=①+②=△H1+△H2,由反应达平衡状态,所以v1正=v1逆、v2正=v2逆,所以v1正×v2正=v1逆×v2逆,即k1正c2(NO)×k2正c(N2O2)c(O2)=k1逆c(N2O2)×k2逆c2(NO2),则是K=![]() ;
;
(2)因为决定2NO(g)+O2(g)2NO2(g)速率的是反应②,所以反应①的活化能E1远小于反应②的活化能E2;
II .(3)满足平衡条件υ(NO2)=2υ(N2O4)即为平衡点,B、D点的压强之比等于其反应速率之比为1:2,所以B、D为平衡点;
(3)反应后溶液中c(NH4+)=c(Cl-)=0.01mol/L,c(NH3H2O)=![]() mol/L-c(NH4+)=
mol/L-c(NH4+)=![]() mol/L,c(OH-)=10-7mol/L,则Kb=
mol/L,c(OH-)=10-7mol/L,则Kb=![]() =
= =(2×10-9 )/(a-0.02);设氨水的体积为VmL,则根据稀释定律可知:V×0.93g·cm-3×17%=amol·L-1×0.2L,解得V=21.5a mL。
=(2×10-9 )/(a-0.02);设氨水的体积为VmL,则根据稀释定律可知:V×0.93g·cm-3×17%=amol·L-1×0.2L,解得V=21.5a mL。
(4)NO得电子生成铵根,离子方程式为NO+5e-+6H+=NH4++H2O,为阴极反应,阳极上SO2失电子形成硫酸。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】NO和CO都是汽车尾气中的有害物质,它们缓慢起反应生成氮气和二氧化碳,即:2NO+2CO2CO2+N2,对此反应下列叙述正确的是( )
A. 使用催化剂不改变反应速率B. 降低压强,反应速率增大
C. 升高温度能加快反应速率D. 增加N2的浓度,反应速率减慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中既是氧化还原反应又是吸热反应的是
A. 钾与水的反应
B. 灼热的木炭与CO2反应
C. 酒精的燃烧反应
D. Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列有关晶体的叙述中,错误的是( )
A. 离子晶体中一定含有离子键B. 原子晶体中,只存在共价键
C. 构成分子晶体的物质中不存在共价键D. 稀有气体的原子易形成分子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有8种物质:①乙烷;②乙烯;③乙炔;④苯;⑤甲苯;⑥溴乙烷;⑦聚丙烯;⑧环己烯。其中既不能使酸性KMnO4溶液褪色,也不能与溴水反应而使溴水褪色的是
A.①②③⑤ B.①④⑥⑦
C.④⑥⑦⑧ D.②③⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】S2Cl2是一种重要的化工产品。常温时是一种有毒并有恶臭的金黄色液体,熔点-76℃,沸点138℃,易与水反应,进一步氯化可得SCl2。SCl2是樱桃红色液体,易挥发,熔点-122℃,沸点59℃。SCl2 与S2Cl2相似,有毒并有恶臭,且更不稳定。S2Cl2可用下列装置制备。
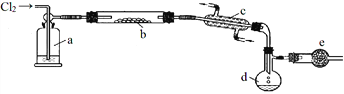
回答下列问题:
(1)写出S2Cl2的电子式________________;装置a中的试剂是________________。
(2)写出实验室制取Cl2的离子反应方程式________________________
(3)装置b中发生反应前,需进行的操作是________________________;
(4)装置e作用是___________________________;
(5)为了获得到纯净的S2Cl2,需要进行的操作名称是________________;
(6)将S2Cl2放入水中会产生沉淀和气体,写出S2Cl2与水反应的化学方程式________________。检验所产生的气体的方法是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作中最终可以得到Al(OH)3的是( )
A. Al2O3和水混合加热
B. 过量的稀HCl加入到Na[Al(OH)4]溶液中
C. 过量的NaOH溶液加入到AlCl3溶液中
D. 过量的氨气通入到AlCl3溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)在S2、Fe2+、Fe3+、Mg2+、S、I、H+中,只有氧化性的是____________,只有还原性的是____________,既有氧化性又有还原性的是________。
(2)某同学写出以下三个化学方程式(未配平):
①NO+HNO3→N2O3+H2O ②NH3+NO→HNO2+H2O ③N2O4+H2O→HNO3+HNO2
其中你认为一定不可能实现的是____________。
(3)下列三个氧化还原反应中,氧化性最强的物质是______________。
①2FeCl3+2KI![]() 2FeCl2+2KCl+I2
2FeCl2+2KCl+I2
②2FeCl2+Cl2![]() 2FeCl3
2FeCl3
③2KMnO4+16HCl(浓)![]() 2KCl+2MnCl2+5Cl2↑+8H2O
2KCl+2MnCl2+5Cl2↑+8H2O
若溶质中Cl与I共存,为了氧化I而Cl不被氧化,除单质外,还应用上述反应中的__________作氧化剂。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一小块金属钠长时间置于空气中,可能有下列现象,这些现象出现的先后顺序是( )
①变成白色粉末 ②变暗 ③变成白色固体 ④表面有液体生成
A. ①②③④B. ②③④①C. ②③①④D. ③②④①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com