
【题目】工业上利用粗ZnO(含FeO、CuO)制取金属锌的流程如下(部分步骤省略):

已知:几种离子形成氢氧化物沉淀时的pH如下表:
待沉淀的离子 | Fe2+ | Fe3+ | Zn2+ | Cu2+ |
开始沉淀时pH | 6.3 | 1.5 | 6.2 | 5.2 |
沉淀完全时pH | 9.7 | 3.2 | 8.0 | 6.4 |
请回答下列问题:
(1)酸浸粗氧化锌的过程中,常将粗氧化锌粉碎成细颗粒,适当增加硫酸的浓度,目的是_________。
(2)步骤A的目的是将Fe2+氧化为Fe3+,并全部形成Fe(OH)3沉淀,为了暂不形成Cu(OH)2 Zn(OH)2 ,该步骤需控制溶液pH的范围是____________,该步骤中先加入H2O2充分反应后再加入氨水,写出加入H2O2的离子方程式_____________。
(3)步骤C的反应离子方程式为____________。
(4)若步骤A中加入H2O2后,室温下将溶液的pH调为4,求Fe3+ 离子浓度为_________。(已知Ksp[Fe(OH)3]= 4.0×10-3 8)
【答案】加快反应速率 3. 2≤pH<5.2 2Fe2++H2O2+2H+=2Fe3++2H2O Cu2+ + Zn = Zn2+ + Cu 4 ×10-8
【解析】
(1)根据影响化学反应速率的因素,酸浸粗氧化锌的过程中,为了加快酸浸速率,可采取的措施有将粗氧化锌粉碎成细颗粒、适当增加硫酸的浓度、适当升高温度等,故目的是加快反应速率;
(2)氢氧化铁沉淀时的pH是1.48 ~ 3.2 ,Zn(OH)2沉淀时的pH为6.2 ~ 8.0,和Cu(OH)2沉淀时的pH为5.2~6.4,因此将Fe2+氧化为Fe3+,并全部形成Fe(OH)3沉淀,为了暂不形成Cu(OH)2、Zn(OH)2 ,该步骤需控制溶液pH的范围为3.2<pH<5.2,加入H2O2 ,发生过氧化氢氧化亚铁离子的反应,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)步骤C中加入锌,发生锌和硫酸铜反应生成铜和硫酸锌,反应离子方程式为Cu2++Zn=Zn2++Cu;
(4) 若步骤A中加入H2O2后,室温下将溶液的pH调为4,c(H+)=10-4mol/L,c(OH-)=10-10mol/L,Ksp[Fe(OH)3]= c(Fe3+)c3(OH-)= c(Fe3+)× (10-10mol/L) 3=4.0×10-38,故c(Fe3+)=4.0×10-8 mol/L。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】溴苯是不溶于水的液体,常温下不与酸、碱反应,可用如图装置制取(该反应放出热量)。制取时观察到烧瓶中有大量红棕色蒸气,锥形瓶中导管口有白雾出现等现象。
![]()

下列说法错误的是
A.制备溴苯的反应属于取代反应
B.白雾出现是因为HBr易挥发且极易溶于水
C.装置图中长直玻璃导管仅起导气作用
D.溴苯中溶有少量的溴,可用NaOH溶液洗涤除去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究碳酸钙与盐酸反应的反应速率,某同学通过实验测定碳酸钙固体与足量稀盐酸反应生成CO2的体积随时间的变化情况,绘制出下图所示的曲线。下列有关说法中不正确的是

A. 在0-t1、t1-t2、t2-t3中,t1-t2生成的CO2气体最多
B. 因反应放热,导致0-t1内的反应速率逐渐增大
C. t2-t3的速率V(CO2)= ![]() mL/s
mL/s
D. 将碳酸钙固体研成粉末,则曲线甲将变成曲线乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 是具有相同电子层结构的短周期元素形成的简单离子。下列叙述正确的是
是具有相同电子层结构的短周期元素形成的简单离子。下列叙述正确的是
A.原子半径: C>D>A>BB.原子序数: b>a>d>c
C.离子半径: D>C>A>BD.单质还原性: A>B>C>D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是

A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(g) + 5O2(g) ![]() 4NO(g) + 6H2O(g)在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率
4NO(g) + 6H2O(g)在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率![]() x
x
A. ![]() (O2) = 0.01mol·(L·s) –1 B.
(O2) = 0.01mol·(L·s) –1 B. ![]() (NO) = 0.008mol·(L·s) –1
(NO) = 0.008mol·(L·s) –1
C. ![]() (H2O) = 0.006mol·(L·s) –1 D.
(H2O) = 0.006mol·(L·s) –1 D. ![]() (NH3) = 0.002mol·(L·s) –1
(NH3) = 0.002mol·(L·s) –1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。回答下列问题:
(1)晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的化学方程式为:2K3[Fe(C2O4)3]![]() 2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为______________。
2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为______________。
(2)某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。

①通入氮气的目的是________________________________________。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有___________、___________。
③为防止倒吸,停止实验时应进行的操作是_____________________________。
④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是:________________。
(3)测定三草酸合铁酸钾中铁的含量。
①称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点。滴定终点的现象是___________________________。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。该晶体中铁的质量分数的表达式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,向A和B中都充人2molX和2molY,起始VA=0.8a L,VB=a L保持温度不变,在有催化剂的条件下,两容器中各自发生下列反应:X(g)+Y(g)![]() 2Z(g)+W(g)达到平衡时,VA=0.9a L,则下列说法错误的是 ( )
2Z(g)+W(g)达到平衡时,VA=0.9a L,则下列说法错误的是 ( )
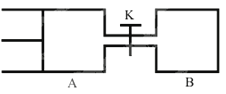
A. 两容器中达到平衡的时间A<B
B. 打开K达到新平衡后,升高B容器温度,A容器体积相比原平衡状态时一定增大
C. A容器中X的转化率为25%,且比B容器中的X的转化率小
D. 打开K一段时间达平衡时,A的体积为0.8a L(连通管中的气体体积不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向两份30mL同一浓度的NaOH溶液中通入CO2气体,因CO2通入量的不同,溶液的组成也不同,得到溶液M、N。若向M、N溶液中逐滴加入浓度为0.25mol·L-1盐酸,产生的气体体积v(CO2)与加入盐酸的体积v(HCl)的关系分别为如图所示两种情况A和B。
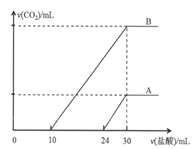
请回答下列问题:
(1)M溶液中溶质为(写化学式)___________,其物质的量之比是__________。
(2)N溶液溶质为(写化学式)____________,标准状况下CO2气体的体积为________,原NaOH溶液的物质的量浓度为_________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com