
分析 (1)将pH=11的氨水稀释100倍后,稀释后的溶液中氢氧根离子浓度大于原来$\frac{1}{100}$;
(2)氨水是弱电解质,存在电离平衡,向溶液中加入相同的离子能抑制氨水电离,据此回答判断;
(3)若将0.1mol NH4Cl和0.05mol NaOH全部溶于水形成混合溶液,溶液中存在NH4+和NH3•H2O,结合物料守恒和电荷守恒解答;
(4)①若溶液中只溶解了一种溶质,该溶质是NH4Cl,氯化铵为强酸弱碱盐,其溶液呈酸性,溶液中存在电荷守恒;
②若上述关系中c(Cl-)>c(H+)>c(NH4+)>c(OH-)是正确的,溶液呈酸性,则溶液中的溶质为氯化铵和HCl;
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,氯化铵溶液呈碱性,要使氨水和稀盐酸混合溶液呈中性,则氨水物质的量应该稍微大些.
解答 解:(1)一水合氨为弱电解质,存在电离平衡,稀释后一水合氨的电离程度增大,溶液中氢氧根离子的物质的量增大,所以将pH=11的氨水稀释100倍后,稀释后的溶液中氢氧根离子浓度大于原来的$\frac{1}{100}$,溶液的pH应该9-11之间,
故答案为:D;
(2)一水合氨是弱电解质,溶液中存在电离平衡,向溶液中加入氯化铵,铵根离子浓度增大,抑制一水合氨电离,导致溶液中氢氧根离子浓度减小,溶液的pH减小,
A.氨水与氯化铵不发生化学反应,故A错误;
B.氯化铵溶液水解显酸性,但铵根离子浓度远远大于氢离子浓度,所以铵根离子抑制一水合氨电离为主,氢离子浓度减小,故B错误;
C.氯化铵溶于水,电离出大量铵根离子,抑制了氨水的电离,使c(OH-)减小,故C正确;
故选:C;
(3)①根据N原子守恒可知,溶液中NH3•H2O和NH4+两种粒子的物质的量之和等于0.1mol,
故答案为:NH3•H2O;NH4+;
②根据电荷守恒式c(NH4+)+c(H+)+c(Na+)=c(OH-)+c(Cl-),则c(NH4+)+c(H+)-c(OH-)=c(Cl-)-c(Na+)=0.1mol-0.05mol,
故答案为:NH4+;H+
(4)①水中含有氢离子和氢氧根离子,若溶液中只溶解了一种溶质,该溶质是NH4Cl,氯化铵为强酸弱碱盐,其溶液呈酸性,所以c(H+)>c(OH-),溶液中存在电荷守恒,根据电荷守恒得c(Cl-)>c(NH4+),盐类水解较微弱,所以离子浓度大小顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故答案为:氯化铵;A;
②若上述关系中c(Cl-)>c(H+)>c(NH4+)>c(OH-)是正确的,溶液呈酸性,则溶液中的溶质为氯化铵和HCl,
故答案为:NH4Cl和HCl;
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,氯化铵溶液呈碱性,要使氨水和稀盐酸混合溶液呈中性,则氨水物质的量应该稍微大些,因为二者体积相等,所以c(HCl)<c(NH3•H2O),
故答案为:<.
点评 本题考查了pH的简单计算,注意明确弱电解质只能部分电离,在溶液中存在电离平衡,注意平衡移动原理的应用,弱电解质电离和盐类水解,侧重考查学生分析计算能力,把握溶液中溶质及其性质是解本题关键,注意电荷守恒及物料守恒的正确灵活运用.


科目:高中化学 来源: 题型:解答题
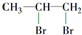 1,2二溴丙烷; ②
1,2二溴丙烷; ②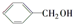 苯甲醇.
苯甲醇. C4H8O; ②
C4H8O; ②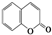 C9H6O2.
C9H6O2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ①③⑥ | C. | ②④⑥ | D. | ①②③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y、Z、W三种元素组成化合物的化学式可能为ZWY | |
| B. | Z与Y、Z与W形成的化合物的化学键类型可能完全相同 | |
| C. | 简单离子的半径:R>W>Y>Z | |
| D. | 因非金属性Y>R,所以X与Y组成化合物的沸点低于X与R组成的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
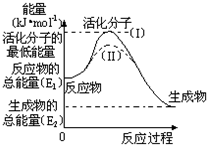 在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ•mol-1表示.请认真观察如图,然后回答问题.
在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ•mol-1表示.请认真观察如图,然后回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na与水反应时增大水的用量 | |
| B. | 恒温恒容条件下,在工业合成氨反应中,增加氮气的量 | |
| C. | 在H2SO4与NaOH两溶液反应时,增大压强 | |
| D. | 将稀H2SO4改为98%的浓H2SO4与Zn反应制取H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷与氯气混合后在光照的条件下发生反应 | |
| B. | 乙烯与水的加成反应 | |
| C. | 1,3-丁二烯与溴的加成 | |
| D. | 2,3-二溴丁烷的消去反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com