
【题目】在一定温度下,可逆反应A(气)+3B(气)![]() 2C(气)若达到平衡的标志是( )
2C(气)若达到平衡的标志是( )
A. C的生成速率与B的生成速率相等B. 混合气体的平均相对分子质量不变
C. 单位时间内生成nmolA,同时生成3nmolBD. A、B、C的分子数之比为1:3:2
【答案】B
【解析】
达到平衡状态时正、逆反应速率相等,正、逆反应速率相等是指用同一种物质来表示的反应速率,不同物质表示的反应速率与化学计量数成正比。
A项、C的生成速率与B的生成速率之比为3:2时,说明正逆反应速率相等,反应达到平衡状态,故A错误;
B项、该反应是一个体积体积减小的反应,由质量守恒定律可知,平衡前后气体质量不变,反应中容器内气体的平均摩尔质量增大,则容器内气体的平均摩尔质量不变,能表明反应已达到平衡状态,故B正确;
C项、单位时间内生成nmolA和生成3nmolB均为正反应速率,不能说明正逆反应速率相等,无法判断是否达到平衡状态,故C错误;
D项、A、B、C三种物质的分子数之比是1:3:2,没有说明保持1:3:2不变,无法判断是否达到平衡状态,故D错误;
故选B。


科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示下列描述正确的是

A. 反应开始到10s,用Z表示的反应速率为0.158 mol/(Ls)
B. 反应开始到10s,X的物质的量浓度减少了0.79 mol/L
C. 反应开始到10s,Y的转化率为79.0 %
D. 反应的化学方程式为:X+Y![]() Z
Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸铅[(CH3COO)2Pb]因有甜味而被称为“铅糖”,它有毒但能入药。已知(CH3COO)2Pb可溶于水,硝酸铅与醋酸钠溶液反应的离子方程式为Pb2++2CH3COO-![]() (CH3COO)2Pb。下列有关说法中不正确的是
(CH3COO)2Pb。下列有关说法中不正确的是
A. 0.1 mol·L-1的“铅糖”溶液中c(Pb2+)<0.1 mol·L-1
B. “铅糖”是强电解质
C. “铅糖”是共价化合物
D. “铅糖”的溶液可能导电性很弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了A~R 10种元素在周期表中的位置(填元素符号):
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | E | J | F | |||||
3 | A | C | D | G | R | |||
4 | B | H |
i. 请填空:
(1)这10种元素中,化学性质最不活泼的是____(填元素符号)。
(2)D元素最高价氧化物对应的水化物与氢氧化钠反应的离子方程式是____。
(3)A、B、C三种元素按原子半径由大到小的顺序排列为____(填元素符号)。
(4)EF2的电子式为____,F元素的最简单氢化物在常温下跟B发生反应的化学方程式是____。
(5)G元素和H元素两者核电荷数之差是____。
ii. 元素J的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中对NH3与NO2反应进行了探究。回答下列问题:
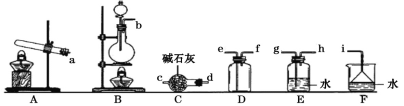
①只用固体药品制备氨气的发生装置可以选择上图中的____,反应的化学方程式为____。
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→____(按气流方向,用小写字母表示)。
③将上述收集到的NH3充入无色透明烧瓶中,并加入少量催化剂,然后充入NO2。常温下反应一段时间后的实验现象为____,反应的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.O2-、F-、Na+、Mg2+半径依次减小
B.O2和O3是氧元素的同素异形体
C.同一元素的不同核素化学性质几乎完全相同
D.同主族元素含氧酸的酸性随核电荷数的增加而减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯是重要的有机化工原料,主要用于生产聚丙烯、丙烯腈、环氧丙烷等.
Ⅰ.(1)以丁烯和乙烯为原料反应生成丙烯的方法被称为“烯烃歧化法”,反应为:C4H8(g)+C2H4(g)![]() 2C3H6(g)。已知:
2C3H6(g)。已知:
①C2H4(g)+3O2(g)═2CO2(g)+2H2O(l)△H 1=-1411KJmol-1
②C3H6(g)+![]() O2(g)═3CO2(g)+3H2O(l)△H 2=-2049KJmol-1
O2(g)═3CO2(g)+3H2O(l)△H 2=-2049KJmol-1
③C4H8(g)+6O2(g)═4CO2(g)+4H2O(l)△H 3=-2539KJmol-1
“烯烃歧化法”的反应的热化学方程式为_____________________。
(2)一定温度下,在一体积恒为 V 升的密闭容器中充入一定量的 C4H8 和 C2H4,发生烯烃歧化法的 主要反应。 t1 时刻达到平衡状态,此时容器中 n(C4H8)=amol,n(C2H4)=2amol,n(C3H6)=b mol, 且 C3H6 占平衡总体积的 1/4。
①求该时间段内的反应速率 v(C4H8)=_____________。 (用只含 a、V、t1 的式子表示)
②判断该反应达到平衡的标志是______________
A.2v (C4H8) 生成=v (C3H6) 消耗
B.C4H8、C2H4、C3H6 的物质的量之比为 1:1:2
C.混合气体的平均相对分子质量不再改变
D.C4H8、C2H4、C3H6 的浓度均不再变化
(3)Kp 是用反应体系中气体物质的分压来表示的平衡常数,即将 K 表达式中平衡浓度用平衡分压代替。已知反应﹕C4H8(g)+C2H4(g)![]() 2C3H6(g),该反应中正反应速率v 正=k 正·p(C4H8)·p(C2H4),逆反应速率 v 逆=k 逆·p2(C3H6),其中 k 正、k 逆 为速率常数,则 Kp 为_________(用 k 正、k 逆表示)。
2C3H6(g),该反应中正反应速率v 正=k 正·p(C4H8)·p(C2H4),逆反应速率 v 逆=k 逆·p2(C3H6),其中 k 正、k 逆 为速率常数,则 Kp 为_________(用 k 正、k 逆表示)。
Ⅱ.“丁烯裂解法”是另一种重要的丙烯生产法,但生产过程中会有生成乙烯的副反应发生.反应如下主反应:3C4H8![]() 4C3H6;副反应:C4H8
4C3H6;副反应:C4H8![]() 2C2H4
2C2H4
测得上述两反应的平衡体系中,各组分的质量分数(w%)随温度(T)和压强(P)变化的趋 势分别如图 1 和图 2 所示:
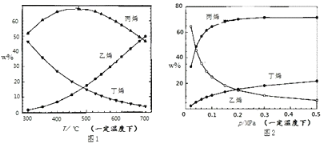
(1)平衡体系中的丙烯和乙烯的质量比是工业生产丙烯时选择反应条件的重要指标之一,从产物的纯度考虑,该数值越高越好,从图 1 和图 2 中表现的趋势来看,下列反应条件最适宜的是_____(填字母序号).
A.300oC 0.1MPa B.700oC 0.1MPa C.300oC 0.5MPa D.700oC 0.5MPa
(2)有研究者结合图 1 数据并综合考虑各种因素,认为 450℃的反应温度比 300℃或 700℃更合适, 从反应原理角度分析其理由可能是________________.
(3)图2中,随压强增大平衡体系中丙烯的百分含量呈上升趋势,从平衡角度解释其原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素原子的 L 层电子数为 ___________;
(2)肼(N2H4)又称联氨。无色油状液体。有类似于氨的刺鼻气味。可作为火箭发动机的燃料。
①)肼中氮元素的化合价为 ____。
②NH3 与 NaClO 反应可得到肼,该反应的化学方程式为_____。
③16g 液态肼在空气中燃烧,生成氮气和水蒸气时放出的热量为 267.1kJ,写出该反应的热化学方程式: ____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关铝及其铝的化合物用途错误的是
A.明矾可用作净水剂
B.Al2O3可用于制作耐火材料
C.Al(OH)3可用于治疗胃酸过多
D.铝制餐具可用于长时间存放酸性、碱性或咸的食物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com