
| A、v(X)=0.03 mol/(L?min) |
| B、v(Y)=0.02 mol/(L?min) |
| C、v(Z)=0.10 mol/(L?min) |
| D、v(w)=0.20 mol/(L?min) |
| ||
| △t |
| ||
| 5min |


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
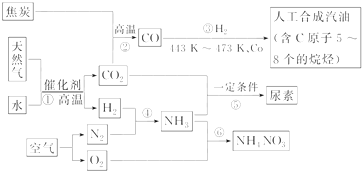
| ||
| 高温高压 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、32 g O2占有的体积约为22.4 L |
| B、22.4 L N2含阿伏加德罗常数个氮分子 |
| C、在标准状况下,22.4 L水的质量约为18 g |
| D、22 g二氧化碳与标准状况下11.2 L HCl约含有相同的分子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡时甲、乙内压强相等 |
| B、平衡时甲、乙中SO3的物质的量相等 |
| C、甲容器内平衡前后压强比为10:9 |
| D、开始时甲、乙两容器的体积比为9:10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 浓硫酸 |
| 170℃ |
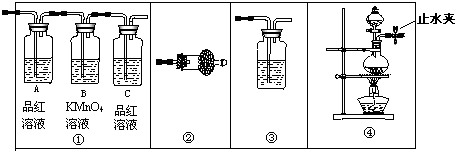
查看答案和解析>>
科目:高中化学 来源: 题型:
| 产品标准 | GB5461 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、22.4LN2含阿伏加德罗常数个氮分子 |
| B、在标准状况下,22.4L水的质量约为18g |
| C、22g二氧化碳与标准状况下11.2LHCl含有相同的分子数 |
| D、在同温同压下,相同体积的任何气体单质所含的原子数相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com