
【题目】处理城市垃圾是一项艰巨的任务,下列废弃物中属于白色污染的是
A.废报纸 B.废塑料 C.废钢铁 D.废电池
科目:高中化学 来源: 题型:
【题目】根据反应KMnO4+FeSO4+H2SO4→MnSO4+Fe2(SO4)3+K2SO4+H2O(未配平)设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol·L-1,溶液的体积均为200 mL,盐桥中装有饱和K2SO4溶液。下列说法不正确的是( )
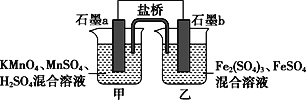
A. 石墨b是原电池的负极,发生氧化反应
B. 甲烧杯中的电极反应式:MnO4-+5e-+8H+===Mn2++4H2O
C. 电池工作时,盐桥中的阴阳离子分别向乙甲烧杯中移动,保持溶液中的电荷平衡
D. 忽略溶液体积变化,Fe2(SO4)3浓度变为1.5 mol/L,则反应中转移的电子为0.1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,不正确的是
A. 二氧化锰与浓盐酸加热反应:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
B. 氯化镁溶液与氨水反应:Mg2++2NH3·H2O=Mg(OH)2↓+2NH
C. 金属钠与水反应:2Na+2H2O=2Na++2OH-+H2↑
D. 氯化铁溶液与碘化钾溶液反应:Fe3++2I-=Fe2++I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W五种短周期元素。X原子的质子数与电子层数相同,W原子核外电子数是M原子最外层电子数的2倍,Y、Z、M、W在周期表中的相对位置如图所示。下列说法不正确的是
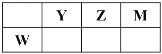
A. 原子半径:W>Y>Z>M>X
B. 热稳定性:XM>X2Z
C. 仅由X、Y、Z三种元素形成的化合物中不可能含离子键
D. WM4分子中每个原子最外层均满足8电子结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知合成氨反应的化学方程式为3H2(g)+N2(g)![]() 2NH3(g),下列说法能表示合成氨反应达到化学平衡状态的是
2NH3(g),下列说法能表示合成氨反应达到化学平衡状态的是
A. v逆(N2)=3v正( H2)
B. 三个H—H 键断裂的同时有六个N—H 键生成
C. NH3的百分含量保持不变
D. c(N2) : c(H2) : c(NH3)=1 : 3 : 2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2014年德美科学家因开发超分辨荧光显微镜获诺贝尔化学奖,他们开创性的成就使光学显微镜分辨率步入了纳米时代。
Ⅰ.制纳米碳酸钙:在浓CaCl2溶液中通入NH3和CO2可以制得纳米级碳酸钙。下图所示A~E为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题。
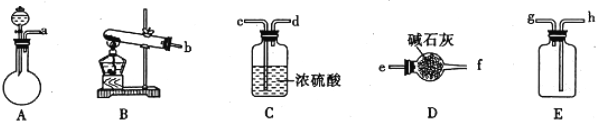
(1)实验室中若用浓氨水和生石灰制取并收集干燥的NH3,请选择装置并按气流方向连接各仪器接口___________(填装置接口顺序);若要制取并收集干燥的CO2,则需选用上述仪器装置中的_____________(填装置序号)。
(2)向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入的气体是______,试写出制纳米级碳酸钙的离子方程式____________________________________。
Ⅱ.纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
(3)制备纳米TiO2:可将TiCl4水解产物经加热脱水制得纳米级TiO2。已知25℃时,Ksp[Ti(OH)4]=7.94×10-54,该温度下测得TiCl4溶液的pH=3,则此时溶液中c(Ti4+)=______________。
(4)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。配制NH4Fe(SO4)2标准溶液时,使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的______________(填字母代号)。

(5)滴定終点的现象是______________________________________________________。
(6)滴定分析时,称取TiO2试样1.80g,消耗0.400mol·L-1 NH4Fe(SO4)2标准溶液45.00mL,则试样中TiO2的质量分数为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关钠及其化合物叙述错误的是。
A. 标准状况下,2.24 L Cl2通入足量NaOH溶液中,反应转移电子的数目为0.1NA个
B. 1molNa2O2与足量的水反应,转移的电子数为2NA个
C. 常温下,2.3g钠投入到100mL水中,钠失去的电子数为0.1NA
D. 0.1mol钠在空气中完全燃烧生成Na2O2,转移的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将4molNH3和5molO2充入定容密闭容器中,在催化剂存在下进行下列反应:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H=- 1025 kJ/mol,当达到平衡状态时,下列说法中正确的是
4NO(g)+6H2O(g) △H=- 1025 kJ/mol,当达到平衡状态时,下列说法中正确的是
A. 生成4molNO B. NH3和NO物质的量之和为4mol
C. 放出1025kJ的热量 D. 平衡时容器内气体压强和开始时压强相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com