
| 操作 | 现象 | 结论 |
| 取少量除尽Ag+后的溶液于试管中,滴加几滴KSCN溶液,振荡 | 溶液呈血红色 | 存在Fe3+ |
| 取少量除尽Ag+后的溶液于试管中,滴加几滴K3[Fe(CN)6]溶液,振荡 | 产生蓝色沉淀 | 存在Fe2+ |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LC2H2、C2H6的混合气体与22.4LC2H4中所含原子总数均为6NA | |
| B. | 常温下,1L PH=14的NaOH溶液中由水电离出的OH-个数为NA | |
| C. | 标准状况下,11.2L的12C16O和14N2的混合气体中所含中子数和原子数的差值为6NA | |
| D. | 将200mL0.1mol•L-1FeCl3溶液制成胶体,所得Fe(OH)3胶体粒子数为0.02NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
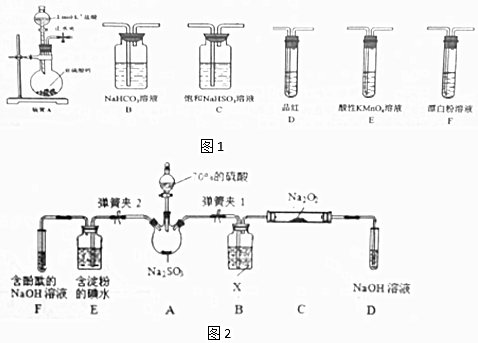
| 操作步骤 | 实验现象 | 解释原因 |
| 关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没三颈烧瓶中固体 | 若将带火星的木条放在D试管口处,木条不复燃 | SO2与Na2O2反应无O2生成,可能发生的化学反应方程式为①Na2O2+SO2=Na2SO4 |
| 若将带火星的木条放在D试管口处,木条复燃 | SO2与Na2O2反应有O2生成,发生的化学反应为:2SO2+2Na2O2═2Na2SO3+O2 | |
| 关闭弹簧夹1,打开弹簧夹2,残余气体进入E,F中. | E中②E 中溶液蓝色褪去 | E中反应的离子方程式③SO2+I2+2H2O=2I-+SO42-+4H+ |
| F中④F 中红色变浅或褪色 | F中反应为2OH-+SO2═SO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a+2 | B. | a+8 | C. | a+26 | D. | a+18 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标况下,22.4升的H2O含有的水分子数为NA | |
| B. | 标况下,11.2升CCl4中含有的Cl原子数为2NA | |
| C. | 17克NH3中含有的电子总数为10NA | |
| D. | 0.5mol/L的H2SO4溶液中含有的H+数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 一定条件下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H<-38.6 kJ•mol-1 | |
| B. | 中和热的测定实验中需要用的主要玻璃仪器:两个大小相同的烧杯、两个大小相同的量筒、温度计、环形玻璃搅拌棒,也可以用保温杯代替烧杯做有关中和热测定的实验 | |
| C. | 在测定中和热的实验中,至少需要测定并记录的温度是3次 | |
| D. | CO(g)的燃烧热是283.0 kJ•mol-1,则CO2分解的热化学方程式为:2CO2(g)═2CO(g)+O2(g)△H=+283.0 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单斜硫转化为正交硫需要吸热 | B. | 单斜硫比正交硫稳定 | ||
| C. | △H4>△H5 | D. | △H4<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 35 C1和37Cl | B. | CH3CH2CH2 CH3和CH (CH3)3 | ||
| C. | CH3CH3和CH3CH2CH3. | D. | H2O和H2O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com